
Автор: врач-инфекционист Евгений Щербина, известный как «инфекционист доказательный».
«Видишь глистов? И я не вижу. А они есть». (с)
Тема глистов волнует родителей ничуть не меньше, чем дисбактериоз и даже прививки. Любой симптом, начиная от боли в животе и заканчивая плохим поведением, пытаются связать именно с глистами. Но каким образом неправильная диагностика приводит к неправильному лечению и почему в этом эпическом противостоянии человека и паразита всегда проигрывают собаки – мы попробуем разобраться в нашей новой статье, опровергая самые распространенные мифы.
Миф №1. Глисты могут быть причиной атопического дерматита
Атопический дерматит — это хроническое заболевание кожи, причиной которого ученые считают генетически запрограммированную предрасположенность (чаще всего родственники больного тоже страдают такими же проблемами) к нарушению ее барьерной функции и быстрому высыханию, благодаря чему большинству внешних раздражителей и аллергенов намного проще вызвать воспаление. Проще говоря, у этой болезни есть свои причины развития и методы лечения, а глисты не имеют к ней никакого отношения. Мало того, современная «гигиеническая гипотеза» предполагает, что более тесный контакт детей с бактериями, вирусами, аллергенами и паразитами может быть причиной снижения частоты аллергических заболеваний, что хорошо прослеживается на примере развивающихся стран.
Миф №2. «Компьютерная диагностика» — эффективный способ диагностики глистов
…а рептилоиды уже совсем скоро прилетят верхом на планете Нибиру и всех нас спасут. Ну, серьезно, здесь даже нечего комментировать – ни в одной цивилизованной стране никакие «компьютерные диагностики», проводимые в полуподвальных помещениях сомнительного вида личностями, не используются и даже строго за это карают.
Миф №3. Паразитов, живущих в кишечнике, можно диагностировать по анализу крови
Мода добралась и до медицины. Современные люди легко верят в дорогие и разрекламированные способы диагностики болезней, в том числе и глистных инвазий. Одним из ярких примеров является диагностика типичных кишечных гельминтов и простейших (в основном аскарид и лямблий) при помощи метода ИФА (определение в организме не самих паразитов, а антител к ним). К сожалению, этот метод в данном конкретном случае имеет много недостатков:
1) он не может точно сказать болеет ли человек сейчас или заражение произошло несколько лет назад.
2) он обладает слабой чувствительностью и специфичностью, то есть высока вероятность как ложноположительных, так и ложноотрицательных результатов.
3) в конце концов, это анализ не самый дешевый.
Для диагностики паразитов, живущих в кишечнике, используют только трехкратная микроскопия кала. Анализ крови (ИФА) только для токсоплазмоза, токсокароза, фасциолеза, описторхоза, эхинококкоза. Выявление всех остальных паразитов анализом крови недостоверно!
Миф №4. Если в доме есть собака, то нужно обязательно всем членам семьи пить профилактически противоглистные препараты.
У собаки и человека общих паразитов, по сути, два: токсокары и эхинококки. Эхинококкозом можно заразиться только при контакте с бродячими собаками, имеющими доступ к внутренностям забиваемых домашних животных. Что касается токсокароза, то владельцы собак имеют такие же шансы заболеть, как и невладельцы, потому что заражение происходит в основном через уличную пыль, содержащую частички животных экскрементов (а у детей, как правило, во время игры в песочнице). Так что, владельцам собак нужно просто убирать за своими питомцами на улице, почаще их купать и давать планово противоглистные препараты – это и будет лучшая профилактика токсокароза. Люди же, которые содержат собаку, ни в какой профилактике не нуждаются.
Миф №5. Всем детям нужно 1-2 раза в год проводить профилактику противогельминтными лекарствами.
Отчасти правда, но она как всегда кроется в деталях. Всемирная организация здравоохранения действительно рекомендует проводить профилактику гельминтов у детей препаратами, только это касается лишь эндемичных зон: раз в год в случае, если распространенность передаваемых через почву гельминтных инфекций превышает 20%, и дважды в год в случае, если этот показатель в сообществе превышает 50%. К счастью, Украина, Казахстан, Белоруссия и Россия не относятся к эндемичным странам, поэтому прием противоглистных препаратов в этих странах проводят только при наличии доказанной инфекции.
Миф №6. Скрежет зубами во сне – достоверный признак глистов.
Скрип зубами (бруксизм) к глистам отношения не имеет и чаще всего исчезает без лечения, однако его могут провоцировать психоэмоциональные перегрузки, стрессы.
Миф №7. Биологически активные добавки (БАДы) могу вылечить глисты не хуже стандартных лекарств.
БАДы в принципе изначально позиционировали себя как обычные пищевые добавки для восполнения витаминов и минералов в организме, но ушлые маркетологи начали продвигать их в качестве лекарственных средств от всех болезней. Наше законодательство позволяет поставить на упаковке маркировку «БАД» и это освобождает от необходимости проводить все необходимые медицинские исследования, как это делается с настоящими лекарствами. Поэтому, если вы видите в интернете, газетах или телевизоре рекламу с призывом купить очередное супер средство от глистов, знайте, что производитель этого «чуда» сам толком не знает, как оно работает и работает ли вообще, потому что его основная задача – заработать, а не вылечить вас. На сегодняшний день ни один из БАДов официально не прошел все необходимые исследования и не доказал своей эффективности как антигельминтное средство.
Миф №8. Лямблии могут проникать в желчный пузырь или печень и вызывать там воспаление.
Лямблии – это паразит, живущий исключительно в тонком кишечнике, потому что любят щелочную среду. Там же они и вызывают соответствующие симптомы: диарею, нарушение пищеварения, слабость, повышение температуры тела. При длительном воздействии желчи лямблии быстро умирают и перспектива их продвижения по желчным протокам в принципе довольно печальная, не говоря уже о полноценной жизни в желчном пузыре.
Миф №9. Маленький ребенок ест песок и землю во время игры на улице, значит ему нужно периодически «гонять глистов»
Хорошего в поедании песка, конечно же, ничего нет. Тем более, если вы не уверены, что этот песок не использовали в качестве туалета дворовые собаки, ведь именно они являются переносчиками токсокароза, как мы уже обсуждали выше. Увы, но если ребенок уже проглотил яйца токсокары, то просто «дать для профилактики» даже реально работающее лекарство не получится, так как дозировка препарата в таком случае, как правило, слишком маленькая для уничтожения гельминтов, и это принесет больше вреда, чем пользы. Получается, что родителям просто нужно тщательно наблюдать за своими детьми (стараться избегать общественных песочниц во время прогулок с ребенком и внимательно следить за тем, чтобы малыш не брал в рот предметы с земли) и вовремя обращаться за медицинской помощью при появлении первых симптомов заболевания. Только врач сможет разобраться, что это за болезнь и подберет правильное лечение.
Миф №10. Для лечения глистов обязательно нужно добавлять сорбенты: активированный уголь, Смекту, Атоксил и т.д.
Ни один из современных протоколов лечения гельминтозов не содержит таких рекомендаций. Множественные исследования показали, что практически в 100% случаев для лечения нужно использовать всего один препарат – антигельминтное средство. Вы о них, скорее всего, уже слышали: альбендазол, мебендазол, пирантел, метронидазол и др. И больше ничего не нужно. Все, что вы будете пить дополнительно по своей собственной воле, добавит только побочных эффектов, но никак не поможет в лечении.
 Белым цветом на карте помечены страны, жители которых не нуждаются в профилактическом приеме противогельминтных препаратов
Белым цветом на карте помечены страны, жители которых не нуждаются в профилактическом приеме противогельминтных препаратов

Источник: https://www.instagram.com/sherbynaevgeniy/?hl=ru
Лечение острого панкреатита у кошек. Глава из Согласованных рекомендаций ACVIM по панкреатиту кошек. 2021г
Содержание:
- Коррекция провоцирующей причины
- Жидкостная терапия
- Противорвотные препараты и желудочно-кишечные прокинетики
- Лечение боли
- Стимуляторы аппетита
- Питание
- Другие методы лечения кошек с острым панкреатитом
- Продвинутая жидкостная терапия
- Антибиотики
- Кортикостеройды
- Лечение респираторных осложнений
- Хирургия поджелудочной железы
- Другие терапевтические стратегии
- Прогноз при остром панкреатите
Journal of Veterinary Internal Medicine
Перевод с англ.: ветеринар Васильев АВ
Всякий раз, когда это возможно, провоцирующая причина острого панкреатита должна быть устранена или проведено ее лечение. Однако сделать это может быть трудно, потому что большинство случаев панкреатита у кошек являются идиопатическими. Лечение острого панкреатита у кошек преимущественно поддерживающее и симптоматическое. Большинство рекомендаций по лечению экстраполируются из рекомендаций по лечению острого панкреатита у людей и собак, экспертных заключений или экспериментально индуцированных моделей панкреатита у кошек.
Лечение осложнений (например, липидоз печени, холестаз, острое повреждение почек, пневмония, шок, миокардит, диссеминированное внутрисосудистое свертывание крови, полиорганная недостаточность), а также диагностика и лечение сопутствующих заболеваний (например, сахарный диабет, диабетический кетоацидоз, холангит, хроническая энтеропатия) играют важную роль в успешном лечении. У людей нет ни одного доказанного специфического фармакологического метода лечения, изменяющего естественное прогрессирование острого панкреатита, хотя изучаются новые терапевтические мишени и фармакологические агенты. Например, недавно антагонист функционально –связанного антигена 1 лейкоцитов (LFA‐1) был одобрен для лечения острого панкреатита у собак в Японии (личное сообщение, Joerg Steiner 2020). Цели лечения острого панкреатита сосредоточены на жидкостной терапии, лечении боли, контроле рвоты и явной тошноты, а также пищевой поддержке.
1. Коррекция провоцирующей причины
С панкреатитом ассоциировано несколько заболеваний и факторов риска, некоторые из которых позволяют проводить специфическое лечение. Некоторые инфекционные агенты, которые вызывают системные заболевания, и могут вызывать панкреатит, такие как Toxoplasma gondii или другие, которые редко могут вызывать панкреатит, такие как Amphimerus pseudofelineus или Erytrema procyonis, поддаются лечению. Однако, поскольку такие случаи единичны, как правило, нет необходимости тестирования на наличие этих микроорганизмов. Следует тщательно собирать анамнез применения лекарственных препаратов и, по возможности, избегать тех препаратов, которые могут вызвать панкреатит у кошек или животных других видов.
2. Жидкостная терапия
Внутривенное введение кристаллоидов назначается для коррекции обезвоживания и электролитного дисбаланса. В дополнение к неблагоприятным последствиям гиповолемии поджелудочная железа также подвержена изменению кровотока в результате повышения проницаемости сосудов (из-за воспаления и повреждения ацинарных клеток) и образования микротромбов (из-за гиперкоагуляции). Восстановление нормоволемии с помощью ранней внутривенной жидкостной терапии может ограничить повреждение тканей путем улучшения перфузии поджелудочной железы и доставки кислорода. У людей ранняя агрессивная гидратация лактированным раствором Рингера ускоряет клиническое улучшение у пациентов с острым панкреатитом. Продолжительность клинических симптомов до поступления в клинику прямо пропорциональна шансам смерти, что объясняется, по крайней мере частично, гиповолемией.
Обезвоживание, анорексия, рвота и диарея могут привести к гипоперфузии, что приводит к метаболическому ацидозу и преренальной азотемии, которые могут быть скорректированы жидкостной терапией. Одновременная гипогликемия, диабетический кетоацидоз и заболевание почек могут способствовать развитию метаболического ацидоза. Дальнейшие исследования необходимы для определения идеального выбора жидкости для лечения острого панкреатита у кошек, но лактированный раствор Рингера или аналогичный раствор (например, ацетатный раствор Рингера) часто является первым выбором. Жидкостная терапия при лечении острого панкреатита кошек должна тщательно контролироваться, чтобы избежать чрезмерной гидратации.
3. Противорвотные препараты и желудочно-кишечные прокинетики
Рвота и явная тошнота часто отмечаются у кошек с панкреатитом, но реже, чем у собак. Противорвотные средства важны для минимизации потерь жидкости и электролитов, а также для снижения вероятности регургитации и вторичного эзофагита. Адекватный контроль тошноты и рвоты, вероятно, позволяет обеспечить более раннюю переносимость либо добровольного приема per os, либо кормления через трубку. Наиболее часто используемым противорвотным средством у кошек является цитрат маропитанта, антагонист рецептора нейрокинина1 (NK1R), который действует как центрально, так и периферически, ингибируя связывание вещества Р с NK1R, расположенным в рвотном центре, триггерной зоне хеморецепторов и желудочно‐кишечном тракте. Как инъекционный, так и пероральный маропитант часто используется для лечения рвоты у кошек. Маропитант может иметь дополнительные преимущества, такие как висцеральная анальгезия и противовоспалительная активность.
Ондансетрон является антагонистом рецептора 5‐гидрокситриптамина3 (5HT3), который ингибирует серотонин‐индуцированную стимуляцию вагусной афферентной активности, а также может быть использован в качестве основного или дополнительного противорвотного средства. Поскольку антагонисты маропитанта и 5НТ3 действуют при помощи различных механизмов, эти препараты при необходимости можно использовать в комбинации. У кошек с функциональным гастропарезом или непроходимостью кишечника прокинетическое лечение может быть эффективным для улучшения моторики.
Метоклопрамид обладает сомнительными центральными противорвотными эффектами у кошек, но при введении в виде инфузии с постоянной скоростью метоклопрамид увеличивает опорожнение желудка и уменьшает атонию желудка. В одном исследовании предполагалось противопоказание к применению метоклопрамида из-за антагонизма дофамина у кошек с панкреатитом, но ни одно клиническое исследование не подтвердило такое противопоказание. Цизаприд является эффективным пероральным прокинетиком у кошек и является препаратом выбора при замедленном опорожнении желудка. Было также показано, что эритромицин обладает желудочным прокинетическим эффектом у кошек.
4. Лечение боли
Боль трудно оценить у кошек. Многоаспектная комплексная шкала боли Universidade Estadual Paulista (UNESP)‐Botucatu (MCPS) утверждена для оценки послеоперационной боли у кошек, но необходимы утвержденные системы оценки боли, специально предназначенные для использования при лечении кошек с панкреатитом. Хотя боль в животе реже отмечается у кошек с острым панкреатитом, по сравнению с людьми или собаками, она, вероятно, недооценивается. Опиоиды следует использовать в качестве основных анальгетиков для кошек с острым панкреатитом.
Бупренорфин подходит для большинства кошек, в то время как метадон или фентанил являются хорошим выбором анальгетиков для кошек с более сильной болью. Экспериментальные данные указывают на то, что цитрат маропитанта также может обеспечивать висцеральную анальгезию. Перорально вводимый бупренорфин или маропитант могут быть использованы для обезболивания у амбулаторных пациентов. Кроме того, трамадол, габапентин или комбинация этих 2 препаратов могут рассматриваться в качестве пероральных анальгетических препаратов.
5. Стимуляторы аппетита
У большинства кошек с острым панкреатитом отсутствует аппетит, что может способствовать недостаточному питанию и нарушению желудочно-кишечного барьера и иммунной функции. Поэтому восстановление потребления пищи является важным фактором выздоровления. При панкреатите легкой и средней степени тяжести стимуляторы аппетита часто являются эффективным способом восстановления добровольного приема пищи. Наиболее часто назначаемыми стимуляторами аппетита у кошек являются миртазапин и капроморелин. Миртазапин был оценен у кошек с отсутствием аппетита, но может иметь побочные эффекты (например, вокализация, возбуждение, рвота, аномальная походка или атаксия, тремор, гиперсаливация, тахипноэ, тахикардия, вялость) с более неблагоприятными эффектами, отмеченными при более высоких дозировках.
Дополнительным преимуществом миртазапина может быть его противорвотная активность. Мазь с миртазапином может использоваться у кошек и, как правило, хорошо переносится и эффективна. Сообщалось о безопасности и эффективности перорального раствора капроморелина в качестве стимулятора аппетита для здоровых кошек. Кроме того, капроморелин недавно был одобрен для использования у кошек с хронической болезнью почек в США и может рассматриваться как стимулятор аппетита у кошек с панкреатитом.
6. Питание
Пищевая поддержка играет центральную роль в лечении острого панкреатита у человека. Отсутствие энтерального питания может привести к нарушению моторики желудочно-кишечного тракта, атрофии кишечных ворсинок, нарушению кишечного кровотока, нарушению барьерной функции и нарушению нормальной кишечной микрофлоры. Таким образом, у пациентов с тяжелым острым панкреатитом раннее энтеральное питание рассматривается в качестве активного терапевтического вмешательства, которое сводит к минимуму инфицированный панкреонекроз и уменьшает частоту полиорганной недостаточности, тем самым улучшая результат. Напротив, длительное голодание или парентеральное питание не рекомендуется, за исключением ситуации, когда энтеральное питание невозможно обеспечить.
Раннее энтеральное питание оценивали в проспективном рандомизированном исследовании людей с тяжелым острым панкреатитом и сравнивали назоеюнальный и назогастральный способы питания. Было установлено, что энтеральное питание переносится обоими путями без каких-либо различий в показателях исхода. The International Consensus Guidelines Committee поддерживает использование назогастрального зондового питания у людей с острым панкреатитом в течение 24 часов после госпитализации. У пациентов с тяжелым острым панкреатитом энтеральное питание может быть обеспечено введением пищи в желудок или тощую кишку, если пероральное кормление не переносится.
Доступна ограниченная информация об оптимальном питании при лечении острого панкреатита кошек. Данные исследований людей с панкреатитом и результаты экспериментальных и клинических исследований на животных поддерживают использование энтерального питания. Поскольку у большинства кошек с панкреатитом отсутствует аппетит в течение вариабельного периода времени, любое воздержание от пищи может быть вредным и не рекомендуется. Кроме того, у некоторых кошек, если у них отсутствует аппетит или им не дают пищу, развивается печеночный липидоз, что существенно увеличивает смертность. У кошек с острым панкреатитом пероральное кормление или энтеральное питание через зонд следует начинать рано.
Кошки с легким и умеренным острым панкреатитом часто начинают есть с соответствующей поддерживающей и симптоматической помощью, в то время как в тяжелых случаях с осложнениями часто требуется зондовое кормление для адекватного питания. Кроме того, пищевой зонд может использоваться для гидратации, введения пероральных лекарственных препаратов и для декомпрессии желудка, когда это показано. Диетические потребности кошек с острым панкреатитом не определены. Кошки имеют высокие диетические потребности в белке, что делает их восприимчивыми к белково ‐ энергетическому недоеданию и потере мышечной массы во время голодания. Кроме того, кошки имеют более высокую толерантность к пищевым жирам, чем собаки.
Кроме того, снижение содержания в пище аргинина и метионина может ограничивать синтез печеночных липопротеинов и фосфолипидов, что может способствовать развитию печеночного липидоза Рекомендуются высокоусвояемые диеты, часто обозначаемые как “желудочно-кишечные диеты». Тяжелобольные кошки склонны к отвращению к пище, и может быть разумно отложить использование долгосрочной диеты выбора до тех пор, пока состояние кошки не улучшится и она будет питаться в домашних условиях.
Установка энтерального пищевого зонда показана кошкам, которые не реагируют на стимуляторы аппетита в течение 48 часов, или тем, у кого в анамнезе была более длительная анорексия до поступления в клинику. Носопищеводные зонды или эзофагостомы являются наиболее часто размещаемыми зондами при лечении кошек с острым панкреатитом. Носожелудочные зонды также подходят для кратковременного использования у госпитализированных кошек и позволяют проводить отсасывание содержимого желудка по показаниям. Однако, носожелудочное отсасывание у людей с панкреатитом, как сообщается, приводит к усилению вздутия желудка, желудочно‐пищеводному рефлюксу, боли, а также тошноте и эффективность аспирации желудочного еще не оценивали у кошек с панкреатитом.
Гастростомные и еюностомные зонды, размещаемые эндоскопически или хирургически используются реже. Носопищеводные зонды экономичны и легко устанавливаются под местной анестезией, избегая необходимости в общей анестезии, и являются хорошим выбором для кратковременной питательной поддержки госпитализированных или сильно ослабленных кошек. При использовании носопищеводных зондов питание ограничивается жидкой диетой. Установка эзофагостомических зондов требует общей анестезии и большей квалификации, но является отличным вариантом, когда ожидается длительное кормление.
Эзофагостомные зонды позволяют задавать влажные корма в виде каши. Для кошек, у которых энтеральное питание не является возможным из‐за неуправляемой рвоты, кратковременное питание может быть обеспечено частичным или полным парентеральным питанием. Однако выживаемость кошек, получающих исключительно частичное парентеральное питание, ниже, чем у кошек, получающих дополнительное энтеральное питание.
7. Другие методы лечения кошек с острым панкреатитом
В дополнение к поддерживающей и симптоматической помощи кошки с тяжелым некротизирующим панкреатитом и осложнениями или сопутствующими заболеваниями нуждаются в интенсивной терапии. Показатели тяжелого панкреатита включают выраженную дегидратацию (т. е. 8% -10%), стойкие клинические признаки, несмотря на медикаментозное лечение, гипотензию, гипогликемию, ионизированную гипокальциемию или некоторые их комбинации. Тяжелые осложнения могут включать синдром системного воспалительного ответа, сердечно-сосудистый шок, диссеминированное внутрисосудистое свертывание крови, тромбоэмболию легочной артерии или полиорганную недостаточность.
8. Продвинутая жидкостная терапия
Жидкостные, электролитные и кислотно‐основные дисбалансы должны быть оценены и исправлены как можно раньше. В дополнение к коррекции дегидратации и жидкостной поддержки кристаллоидами, терапия при помощи коллоидных растворов полезна, когда показана для поддержки коллоидного осмотического давления и предотвращения дисбаланса жидкости и образования отеков. Свежезамороженная плазма обеспечивает коллоидную поддержку за счет дополнения альбумина и является терапевтическим средством для коррекции коагулопатий, вторичных по отношению к диссеминированному внутрисосудистому свертыванию.
Исследования на собаках показывают, что при истощении α2‐макроглобулина, белка-поглотителя активированных протеаз в сыворотке крови, быстро наступает смерть. Свежая цельная кровь и свежезамороженная плазма содержат α2‐макроглобулин. Однако в клинических испытаниях на людях и в ретроспективном исследовании на собаках с острым панкреатитом польза введения плазмы для увеличения выживаемости не была продемонстрирована. Кроме того, свежезамороженная плазма не рекомендуется в современных согласованных рекомендациях по лечению острого панкреатита у людей. Хотя остаются некоторые вопросы о потенциальном благотворном влиянии плазмы, это дорогостоящее лечение, которое, вероятно, следует зарезервировать для кошек с коагулопатией.
Синтетические коллоиды (например, гидроксиэтилкрахмал, декстран) и гипертонический физиологический раствор являются экономически эффективными альтернативами свежезамороженной плазмы крови. Однако они обеспечивают только коллоидную поддержку, а не добавление факторов свертывания. Ни один из этих продуктов не был оценен у кошек с панкреатитом, и они, как правило, зарезервированы для животных с тяжелым заболеванием и гипотензией, рефрактерными к введению кристаллоидов. У кошек, получающих агрессивную жидкостную поддержку, важно избегать перегрузки объемом, контролируя частоту дыхания и усилие при дыхании, выполняя легочную аускультацию и измеряя центральное венозное давление.
Кошки, имеющие гипотензию, несмотря на кристаллоидную и коллоидную жидкостную терапию, могут нуждаться в вазопрессорной поддержке. Допамин является вазопрессором, который также может увеличить панкреатический кровоток и уменьшить проницаемость микрососудов. Однако его влияние на перфузию поджелудочной железы является преходящим, и допамин может вызывать рвоту. В одном исследовании прогрессирование экспериментального панкреатита у кошек можно было предотвратить с помощью низкодозированной допаминовой терапии, но только при введении в течение 12 часов после индукции панкреатита. Хотя этот срок ограничивает клиническую полезность допамина у кошек со спонтанным панкреатитом, допамин может быть полезен у кошек с панкреатитом, которые должны подвергаться анестезии. У постоянно гипотензивных кошек дополнительные вазопрессоры включают норадреналин, вазопрессин и адреналин.
9. Антибиотики
У людей антибиотики не рекомендуются при лечении острого панкреатита, за исключением случаев сильного подозрения на наличие инфекции или подтверждения ее наличии. В ветеринарной медицине острый панкреатит считается стерильным процессом на основании того, что в большинстве случаев невозможно обнаружить рост микроорганизмов с помощью обычных бактериальных питательных сред. Антибиотики не рекомендуются при неосложненных случаях панкреатита. Сообщения о бактериальных осложнениях, таких как абсцесс поджелудочной железы, встречаются редко. Антибиотики широкого спектра действия должны быть зарезервированы при лечении кошек с острым панкреатитом, если есть подозрение на инфекцию или она подтверждена (например, панкреатический абсцесс, инфицированные некротические ткани), восходящей инфекции из общего панкреатического или желчного протоков, или данные общего анализа крови указывают на сепсис.
Бактериальные инфекции могут встречаться при сопутствующих заболеваниях, в том числе холангите и аспирационной пневмонии. Флуоресцентная гибридизация in situ выявила бактерии в поджелудочной железе 35% кошек с умеренным и тяжелым панкреатитом. Локализация и тип интрапанкреатических бактерий указывают на транслокацию кишечных бактерий в качестве вероятного источника. Однако на сегодняшний день нет доказательств, подтверждающих наличие бактериальной ДНК в ткани поджелудочной железы как имеющее клиническое значение, и поэтому авторы настоящих рекомендаций не рекомендуют использовать антибиотики у кошек с панкреатитом, если нет сильных клинических показаний. Кроме того, применение антибиотиков может быть связано с побочными эффектами и развитием множественной лекарственной устойчивости.
10. Кортикостероиды
Кортикостероиды обычно не используются для лечения острого панкреатита у людей, собак или кошек. Исторически сложилось так, что было нежелание использовать кортикостероиды для лечения панкреатита из-за опасений, что глюкокортикоиды могут быть фактором риска развития панкреатита. Однако окончательная связь между глюкокортикоидами и острым панкреатитом у людей не установлена, и несколько исследований показывают, что они не вызывают панкреатита у собак. Кортикостероиды обладают широким спектром противовоспалительных эффектов и исследования показывают, что они играют ключевую роль в усилении апоптоза и увеличении выработки белка, ассоциированного с панкреатитом, который оказывает защитное действие, направленное против воспаления поджелудочной железы.
Глюкокортикоиды также могут лечить критическую кортикостероидную недостаточность, ассоциированную с заболеванием, о чем сообщается у людей с острым панкреатитом. Недавние исследования по оценке глюкокортикоидов для лечения острого панкреатита у человека и собаки показали улучшение исходов. Однако, нет исследований, которые бы оценивали применение глюкокортикоидов при лечении кошек с острым панкреатитом, и, таким образом, нет достаточных доказательств, чтобы рекомендовать их стандартное использование.
Подобно антибиотикам, кортикостероиды полезны при лечении некоторых сопутствующих заболеваний, включая хроническую воспалительную энтеропатию и стерильный холангит, и их следует рассматривать при наличии этих сопутствующих заболеваний. Однако кортикостероиды также ассоциированы с важными побочными эффектами, по которым кошки с панкреатитом уже находятся в группе риска (например, сахарный диабет).
11. Лечение респираторных осложнений
Тахипноэ и затрудненное дыхание являются частыми осложнениями тяжелого панкреатита у кошек и могут быть вызваны плевральным выпотом или отеком легких, вторично по отношению к острому поражению легких, острому респираторному дистресс-синдрому, перегрузке объемом, застойной сердечной недостаточности, аспирационной пневмонии, тромбоэмболии легочной артерии, болью или их сочетанием. Рентгенограммы грудной клетки и допплеровская эхокардиография часто позволяют быстро поставить диагноз и скорректировать лечение. Торакоцентез с анализом плевральной жидкости показан кошкам с плевральным выпотом. Хотя было сообщено, что обнаружение одновременных плевральных и перитонеальных выпотов указывает на плохой или тяжелый прогноз, не таков опыт авторов настоящих рекомендаций при лечении кошек с панкреатитом. Дифференциация плеврального выпота, вторичного по отношению к застойной сердечной недостаточности, от плеврального выпота, вызванного панкреатитом, критически важна для точной модификации жидкостной терапии и начала лечения диуретиками. У кошек с аспирационной пневмонией показано лечение антибиотиками и кислородом (при наличии гипоксемии).
12. Хирургия поджелудочной железы
У людей с острым панкреатитом, наиболее распространенное показание для инвазивных процедур, инфицированный некроз, сейчас, как правило, лечится с помощью малоинвазивных подходов (например, чрескожно, эндоскопически, лапароскопически или ретроперитонеально), и традиционной открытой резекции омертвевшей ткани обычно избегают из-за риска серьезных осложнений или смерти.Хирургическое лечение редко показано у кошек с острым панкреатитом и четкие указания для выполнения операции пока не определены. У кошек с тяжелым острым панкреатитом и сопутствующей внепеченочной билиарной обструкцией или абсцессом поджелудочной железы хирургическое вмешательство может быть полезным. Однако большинство клиницистов консервативны при рассмотрении вопроса о хирургическом вмешательстве на поджелудочной железе, поскольку большинство кошек с тяжелым панкреатитом являются плохими кандидатами на хирургическое вмешательство, и польза хирургического вмешательства, в том числе у кошек с внепеченочной обструкцией желчных протоков, не была доказана.
13. Другие терапевтические стратегии
Многие другие терапевтические стратегии, включая ингибиторы трипсина (например, апротинин), ингибиторы тромбоцитарного активирующего фактора, антациды (например, ингибиторы протонной помпы), антисекреторные средства (например, антихолинергические средства, кальцитонин, глюкагон, соматостатин), селен и другие антиоксиданты, а также перитонеальный лаваж были оценены в экспериментальных исследованиях или у человеческих пациентов с панкреатитом, но не являются эффективными. Ни одна из этих терапевтических стратегий не была оценена у кошек с панкреатитом, и их стандартное применение не рекомендуется.
Гипербарическая кислородная терапия рекомендуется некоторыми ветеринарными специалистами для лечения панкреатита, но никаких доступных исследований по ветеринарным пациентам нет, и только несколько экспериментальных исследований у грызунов и отчет о случае заболевания у человека доступны. Кроме того, гипербарическая кислородная терапия не была включена в текущие рекомендации по лечению людей с панкреатитом. До тех пор, пока клинические исследования не будут проведены у кошек, стандартное использование этого метода у кошек не может быть рекомендовано.
14. Прогноз при остром панкреатите
Смертность у кошек с острым панкреатитом колеблется от 9% до 41%, основываясь на 4 исследованиях. Кошки с легким и умеренным острым панкреатитом обычно имеют хороший прогноз при соответствующем лечении, в то время как кошки с тяжелым острым панкреатитом, особенно при наличии осложнений или сопутствующих заболеваний, имеют осторожный и тяжелый прогноз. Низкие концентрации ионизированного кальция в плазме крови у кошек с острым панкреатитом были связаны с плохим исходом. Гипогликемия и азотемия также являются плохими прогностическими показателями Смертность у людей с острым панкреатитом, по сообщениям, составляет 5% -15%, но со временем она снизилась, и общая смертность людей с острым панкреатитом составляет примерно 2% при современном стандарте медицинской помощи.
Источник: https://veter96.ru/zabolevaniya/gastroenterologiya/lechenie-ostrogo-pankreatita-u
Автор: Андреева Е. А., ветеринарный врач Ветеринарной клиники неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Содержание:
- Вступление
- Патогенез развития цистита у кошек
- Диагностика
- Лечение
- Заключение
Сокращения: ИЦК – идиопатический цистит у кошек, ИЦ – идиопатический цистит, ОАМ – общий анализ мочи, УЗИ – ультразвуковое исследование, НПВС – нестероидные противовоспалительные средства, ЖКТ – желудочно-кишечный тракт, ОПП – острое повреждение почек.Диагностика
Цистит у кошек – чрезвычайно распространенная причина обращения владельцев на прием к врачу-терапевту. Учащенное мочеиспускание маленькими порциями, гематурия, периурия (мочеиспускание в неположенных местах), вокализация при мочеиспускании, чрезмерное вылизывание перинеальной области – это те симптомы, с которыми врач общей практики сталкивается практически каждый день. С одной стороны, патология довольно проста в диагностике и лечении. Однако такие пациенты нередко способны поставить врача в тупик, поскольку симптомы заболевания могут не разрешиться на фоне лечения или рецидивировать вскоре после окончания курса терапии.
2. Патогенез развития цистита у кошек
Безусловно, у кошек с симптомами цистита в список дифференциальных диагнозов можно включить довольно большое количество патологий, хотя на практике наиболее часто врачи сталкиваются с тремя основными причинами: идиопатический цистит, уролитиаз и инфекция мочевыводящих путей. Врожденные аномалии, нейрогенные нарушения и прочие патологии встречаются гораздо реже. Однако среди трех указанных причин у молодых котов и кошек лидирующее положение занимает именно идиопатический цистит.
Данный тип воспаления нижних отделов мочевыводящих путей у кошек является не только самым распространенным, но и весьма загадочным по своему происхождению. Многочисленные исследования доказали, что одним из факторов, провоцирующих развитие ИЦК, является стресс.
На данный момент нет четкого понимания патогенеза стрессового воздействия, однако ученые склонны считать, что всему виной нарушение ответа нервной системы на воздействие стресс-фактора.
Вторым крайне важным компонентом развития и прогрессирования ИЦ является высококонцентрированная моча. Все дело в том, что моча сама по себе является агрессивной средой. Именно по этой причине стенка мочевого пузыря выстлана двумя защитными слоями: уротелием и покрывающим его гликозаминогликановым слоем. При этом моча у кошек имеет одно значимое отличие от мочи других видов животных – крайне высокую концентрацию, таким образом являясь агрессивной средой. С одной стороны, подобная особенность мочи является защитным механизмом и предотвращает развитие в мочевом пузыре бактериальной флоры, по этой причине коты и кошки в молодом возрасте (в среднем до 8–10 лет) не склонны к развитию инфекций мочевыводящих путей. С другой стороны, при повреждении защитного слоя мочевого пузыря концентрированная моча воздействует на незащищенную стенку, повреждая ее, что в результате приводит к болезненности и спазму. В итоге животное начинает испытывать дополнительный стресс от болевых ощущений в области нижних отделов мочевыводящих путей, и патологический круг замыкается.
Таким образом, в развитии ИЦ принимают участие два механизма: стресс и сильно концентрированная моча.
Идиопатический цистит – это стерильное воспаление. Более того, на начальных этапах оно не приводит к значимым изменениям конфигураций слизистого и подслизистого слоев мочевого пузыря, по этой причине диагноз ИЦ часто называют диагнозом-исключением, поскольку он не характеризуется какими-либо отличительными особенностями. Несмотря на это, постановка диагноза ИЦ, как правило, очень проста и состоит всего из трех этапов: анамнеза, УЗИ мочевого пузыря и общего клинического анализа мочи (ОАМ). УЗИ позволяет исключить уролитиаз и структурные нарушения нижних отделов мочевыводящих путей, а ОАМ подтверждает наличие высокой плотности и отсутствие признаков бактериального воспаления (лейкоцитоза в осадке мочи). Помимо высокой плотности, ОАМ часто выявляет и другие, характерные для ИЦ изменения, которые включают щелочной рН, повышение уровня белка в моче, наличие клеток плоского и переходного эпителия, эритроцитов и кристаллов струвитов в осадке мочи. Некоторые из этих изменений могут быть более выраженными или отсутствовать – все зависит от степени поражения стенки мочевого пузыря.
Однако встречаются случаи, когда для постановки точного диагноза может потребоваться проведение цистоскопии с последующим гистологическим исследованием стенки мочевого пузыря. Во время эндоскопического исследования на уротелии видны характерные участки кровоизлияний, при этом конфигурация слизистой оболочки часто не изменена. Гистологическое исследование выявляет интерстициальный цистит с умеренной гиперплазией подслизистого слоя, расширением сосудов и кровоизлияниями, умеренной инфильтрацией лимфоцитами, легким фиброзом в подслизистом слое. Уротелий, как правило, изъязвлен, и его целостность нарушена.
Коррекция ИЦ состоит из двух основных этапов: купирование стресса и снижение плотности мочи путем увеличения объема потребляемой жидкости. Дополнительные методы, зависящие от степени поражения стенки мочевого пузыря и выраженности симптомов цистита, могут включать применение противовоспалительных, обезболивающих и спазмолитических препаратов. Подобная терапия направлена в первую очередь на купирование острых симптомов, а не на долгосрочный контроль ИЦ.
В целом вылечить ИЦ невозможно, так как животные, у которых обнаруживается данная патология, изначально являются предрасположенными к подобным изменениям. Поскольку рецидивы ИЦ могут наблюдаться в течение всей жизни животного, особенно при наличии предрасполагающих факторов (стресс, малый объем потребляемой жидкости), терапия в основном направлена на снижение частоты рецидивов ИЦ.
Купирование стресса. Существует много способов борьбы со стрессом у кошек, однако самым эффективным из них является устранение того источника стресса, который привел к развитию ИЦ. Проблема заключается в том, что часто эта причина остается неизвестной как владельцам, так и врачу. В этом случае тщательно собранный анамнез может помочь в выявлении причины, поскольку владелец не всегда способен соотнести происходящие с животным события с развитием стресса. Однако и этот метод далеко не всегда оказывается эффективным, поэтому часто врачу приходится бороться с «невидимым врагом».
В подобной ситуации может помочь мультимодальное изменение окружающей среды (multimodal environmental modification – MEMO). Основная идея данного метода заключается в необходимости обеспечить кошку базовыми ресурсами, такими как места для кормления и поения, отдыха, справления нужды и реализации физической активности. Кошка, содержащаяся в домашних условиях, может испытывать дискомфорт при отсутствии тех или иных базовых ресурсов, что и приводит к появлению стресса. Эта проблема может усугубляться, если в доме содержится не одна кошка, а количество ресурсов меньше, чем количество животных в доме.

Способы изменения окружающей среды с целью снижения уровня стресса у кошки с ИЦ.
Обеспечение необходимого количества ресурсов. Миски, лотки, лежанки должны быть в количестве n + 1, где n – количество кошек в доме. Лотки, миски и лежанки должны находиться вдали от проходов и шумно работающих приборов.
Оборудование мест для отдыха. Желательно размещать места для отдыха на разных уровнях, организовывать кошке укрытия, где она при желании может спрятаться, и пробовать подбирать разные конфигурации лежанок (открытые и закрытые, большие и маленькие и т. д.).
Подбор лотка. Лотки часто могут являться дополнительным источником стресса. Чтобы этого не случилось, важно подобрать лоток (закрытый, открытый, с решеткой, с наполнителем и т. д.) и тип наполнителя, наиболее комфортные для кошки. Требуется регулярная уборка лотков.
Увеличение активности помогает снизить уровень стресса у кошки. С этой целью можно использовать специальные игрушки, кормушки-игрушки. Игрушек в доме должно быть в достаточном количестве, периодически следует ограничивать доступ к некоторым из них для поддержания интереса у животного. Играть с кошкой следует только тогда, когда она сама является инициатором взаимодействия с владельцем.
Когтеточки являются отличным средством для снижения стресса. К ним предъявляются такие же требования, как и к остальным базовым ресурсам.
Доступ на улицу. Нежелательно обеспечивать животному свободный доступ на улицу. Однако по возможности стоит организовывать закрытые встраиваемые в окно вольеры или места отдыха на широких подоконниках. При размещении мест отдыха у окна, на широких подоконниках необходимо обязательное наличие защитных сеток на окнах.
Передача кошки в другую семью. В случае невозможности скорректировать ИЦ у кошки, находящейся в семье, где содержатся другие кошки или присутствуют маленькие дети, следует рассмотреть возможность ее передачи в другую семью (без маленьких детей и животных).
Очень важно объяснить владельцу необходимость следовать данным правилам, поскольку, согласно исследованиям, при создании подобных условий частота рецидивирования ИЦ снижается в среднем на 70–75%.
Препараты для снижения стресса. Если одного только MEMO оказывается недостаточно, могут применяться различные препараты, снижающие уровень стресса у кошек. На сегодняшний день существует довольно большой спектр таких препаратов (табл. 1).
В своей практике автор статьи обычно начинает с использования препаратов, указанных в верхней части таблицы, постепенно опускаясь вниз при отсутствии достижения необходимого эффекта от
применения предыдущих.
Способы увеличения объема потребляемой кошкой жидкости:
Расстановка большего количества мисок по дому. Миски с водой должны находиться вдали от кормушек, проходов и шумно работающих приборов.
Использование разных конфигураций мисок. Разные кошки могут предпочитать те или иные конфигурации мисок (широкие, глубокие, узкие и т. д.). Стоит расставить разные емкости с водой по квартире и оценить предпочтения кошки.
Поилки-фонтанчики подойдут для кошек, которым нравится пить текущую воду (например, из-под крана).
Улучшение вкусовых качеств воды. Попробуйте добавлять к воде паштеты, соусы (например, из тунца) и молоко, настаивать воду на кусочках мяса, креветках и пр.
Использование влажных кормов. Идеальным вариантом является полный переход на влажные корма, по возможности дополнительно разбавленные водой.
Добавление воды к корму. Размачивайте сухой корм, делайте супчики: разводите в воде несколько ложек влажного корма и добавляйте в эту воду сухой корм (можно дать корму размокнуть или предлагать сразу, пока корм еще твердый, – все зависит от предпочтений кошки).
Специальные диеты с добавлением NaCl. Такие диеты усиливают жажду, тем самым увеличивая объем потребляемой кошкой воды.
По опыту автора статьи, самым эффективным из перечисленных выше способов является добавление воды к рациону.
Основные цели, которые необходимо достичь при коррекции объема потребляемой кошкой жидкости:
- суточный объем – 40–60 мл/кг;
- плотность мочи – 1,030 и ниже.
Если пациент поступил на прием с острыми симптомами, параллельно с использованием вышеперечисленных методов требуется купирование острого процесса. Для этого применяются обезболивающие, спазмолитические и противовоспалительные препараты (табл. 2).
Из спазмолитиков, как правило, рекомендуются препараты, действующие на уретру (альфа-адреноблокаторы). Применяются они преимущественно у котов для снижения риска развития обструкции уретры на фоне ИЦ. Спазмолитики для детрузора (оксибутинин) обычно не требуются, поскольку при обезболивании болевые импульсы перестают стимулировать гладкую мускулатуру детрузора и спазмы прекращаются.

Из спазмолитиков, как правило, рекомендуются препараты, действующие на уретру (альфа-адреноблокаторы). Применяются они преимущественно у котов для снижения риска развития обструкции уретры на фоне ИЦ. Спазмолитики для детрузора (оксибутинин) обычно не требуются, поскольку при обезболивании болевые импульсы перестают стимулировать гладкую мускулатуру детрузора и спазмы прекращаются.
По наблюдениям автора статьи, наиболее распространенной причиной неудач при лечении ИЦ является плохая комплаентность владельца. В основном она возникает по той причине, что врач не хочет или не может донести до владельца важность соблюдения вышеперечисленных правил в течение всей жизни животного. В связи с этим на приеме крайне важно тщательно разъяснить владельцу все аспекты патогенеза и контроля ИЦК, а главное – важность данных методов и невозможность достижения ремиссии без их постоянного выполнения.
Контроль ИЦ, как правило, осуществляется по симптомам. Авто статьи старается не приглашать владельцев в клинику без лишней на то необходимости, чтобы не провоцировать стресс у животного, но в среднем через 2–4 недели от момента начала лечения рекомендует владельцам пересдать ОАМ для оценки уровня плотности и, соответственно, степени разбавления мочи.
Идиопатический цистит – крайне распространенная патология у молодых кошек с довольно сложным патогенезом и не мене сложными методами ее коррекции. Однако, по мнению автора, практически 100%-ный успех в коррекции данного состояния достигается посредством конструктивного диалога ветеринарного врача с владельцем на первичном приеме. Если вам удалось донести до владельца важность проведения мероприятий по купированию стресса и разбавлению мочи, вас непременно ждет успех.
Источник: https://www.spbvet.info/zhurnaly/5-2020/idiopaticheskiy-tsistit-u-koshek/
Тактика ведения пациентов с нейрогенным мочевым пузырем
Автор: Андреева Е. А., ветеринарный врач-терапевт. Ветеринарная клиника неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург, 2017 год.
Сокращения: ВДН – верхний двигательный нейрон, НДН – нижний двигательный нейрон.
Содержание:
- Вступление
- Дифференциальная диагностика
- Ведение пациентов с нейрогенным мочевым пузырем
- Пациенты с временной атонией мочевого пузыря
- Медикаментозная терапия.
- Пациенты с постоянной атонией мочевого пузыря
Проблема нейрогенного мочевого пузыря довольно актуальна у неврологических пациентов. У многих животных с нарушением иннервации мочевого пузыря, даже успешно перенесших хирургическое вмешательство, развивается бактериальный уроцистит, способный впоследствии привести к развитию пиелонефрита, уросепсиса и гибели животного.
Нейрогенный мочевой пузырь – это группа заболеваний, при которых нарушается иннервация мочевого пузыря. Результатом может быть нарушение фазы опорожнения мочевого пузыря, подтекание мочи, функциональная обструкция мочевого пузыря, реже – нарушение фазы накопления мочи, нарушение взаимодействия мышц детрузора и наружного сфинктера уретры (диссинергия).
Наиболее часто встречаются поражения мочевого пузыря по типу верхнего и нижнего двигательного нейрона.
Для того чтобы разобраться в причинах подобных нарушений, необходимо вспомнить механизм иннервации мочевого пузыря. За иннервацию мочевого пузыря отвечают три нерва: подчревный, тазовый и срамной. Ядра подчревного нерва располагаются в сегментах L1–L4 спинного мозга, ядра тазового и срамного нервов располагаются в сегментах S1–S3 спинного мозга. Центр мочеиспускания находится в стволе мозга. При этом верхним двигательным нейроном для мочевого пузыря является центр мочеиспускания в стволе мозга, а нижним – ядра тазового и срамного нервов в сегментах спинного мозга S1–S3.
В фазу наполнения мочевого пузыря ветви подчревного нерва обеспечивают расслабление детрузора и одновременно смыкание внутреннего гладкомышечного сфинктера мочевого пузыря. При достижении порога растяжимости от рецепторов в мочевом пузыре через тазовый нерв поступают чувствительные импульсы в центр мочеиспускания (ствол мозга). Из ствола мозга в ответ выходят импульсы, активирующие ядра тазового нерва и блокирующие ядра подчревного и срамного нервов. Результатом активации тазового нерва является сокращение детрузора и опорожнение мочевого пузыря (рис. 2). По мере опорожнения мочевого пузыря поступление импульсов от рецепторов растяжения в ствол мозга прекращается, и мочевой пузырь снова переходит в фазу накопления мочи.
При повреждении проводящих путей на любом участке краниальнее сегмента S1 нарушается проведение двигательных импульсов от центра мочеиспускания к ядрам НДН.
В таком случае развивается нейрогенный мочевой пузырь по типу ВДН. При этом детрузор постоянно находится в расслабленном состоянии (стадия накопления мочи), а поперечно-полосатый сфинктер мочевого пузыря всегда находится в тонусе. У такого пациента мануальное отведение мочи может представлять сложность или быть вовсе невозможным. Моча может подтекать при переполнении пузыря, но в небольшом объеме.
При поражении спинного мозга или нервов конского хвоста каудальнее сегмента спинного мозга L7 развивается нейрогенный мочевой пузырь по типу НДН. При этом детрузор находится в стадии наполнения, а поперечно-полосатый сфинктер пузыря – в расслабленном состоянии. У такого пациента моча легко отводится мануально, но полного опорожнения пузыря при этом не наступает. Моча у таких пациентов при переполнении пузыря подтекает часто и большими объемами, особенно в моменты напряжения брюшной стенки.
Для диагностики нарушения иннервации мочевого пузыря проводится неврологический осмотр. При повреждении ВДН характер неврологических нарушений будет зависеть от зоны поражения. Нарушения могут включать в себя парез или паралич грудных и/или тазовых конечностей, проприоцептивный дефицит. При повреждении НДН может наблюдаться вялый паралич тазовых конечностей (отсутствие рефлексов). Поражение седалищного нерва приводит к атаксии тазовых конечностей, снижению рефлекса подтягивания. Поражение срамного нерва приводит к отсутствию анального и промежностного рефлексов.
2. Дифференциальная диагностика
Необходимо помнить, что нарушению мочеиспускания могут способствовать многие состояния не неврологического характера.
При подтекании мочи у кастрированных сук необходимо исключать USMI (недостаточность уретрального сфинктера, связанная с недостатком половых гормонов), инфекции мочевыводящих путей. Молодых животных нужно исследовать на наличие эктопии мочеточников.
При невозможности опорожнения мочевого пузыря необходимо исключить наличие механических преград на пути оттока мочи (уролиты, гиперплазия простаты, стриктуры, воспаление). Это можно сделать посредством постановки уретрального катетера или проведения контрастной уретрографии. Следует помнить, что атония мочевого пузыря может развиваться при его длительном переполнении (частичная обструкция уретры, длительная ОЗМ).
3. Ведение пациентов с нейрогенным мочевым пузырем
Тактика ведения таких пациентов будет зависеть от локализации поражения в нервной системе, предполагаемой продолжительности нарушения иннервации (временная или постоянная) и от полноты нарушения иннервации (полная или частичная).
Две основные проблемы, с которыми мы сталкивается у подобных пациентов, – это развитие инфекции мочевыводящих путей и нарушение оттока мочи из почек, что может привести к их повреждению (рис. 3).
Развитие инфекции у пациентов с нейрогенным мочевым пузырем обусловливается нарушением его защитных механизмов. В частности, задержка мочи в мочевом пузыре и отсутствие полного и своевременного его опорожнения способствуют накоплению бактерий в мочевом пузыре и уретре, а повреждение защитного гликозаминогликанового слоя и эпителия мочевого пузыря из-за перерастяжения стенок и повышенного давления мочи внутри пузыря – размножению бактерий на поверхности эпителия и внутри стенок органа.
Основные правила, которые нужно соблюдать при работе с такими пациентами, – это как можно более частое и полное опорожнение мочевого пузыря и максимальная стерильность. Катетеризации уретры по возможности нужно избегать из-за риска развития инфекции.
Животное удачно восстановилось после травмы ВДН, однако множественные катетеризации мочевого пузыря без соблюдения правил асептики в период восстановления иннервации мочевого пузыря и отсутствие последующего мониторинга привели к тотальному поражению мочевыводящего тракта и гибели животного в результате острой почечной недостаточности и уросепсиса.
4. Пациенты с временной атонией мочевого пузыря
1. Необходимо осуществлять ежедневное отведение мочи. Существуют следующие методы отведения мочи:
- Мануальный. Осуществляется путем надавливания на мочевой пузырь через брюшную стенку. Отведение должно осуществляться 2–4 раза в сутки (чем чаще, тем лучше) до минимально возможного остаточного объема мочи. Мануальное отведение всегда является наиболее предпочтительным из-за низкого риска развития инфекции. Однако пациентам с повреждением ВДН, которым невозможно произвести отведение мочи мануально, необходимо устанавливать уретральный катетер.
Плюсы метода: не происходит проникновения в мочевой пузырь инородных предметов (уретральный катетер), которые могут являться источником инфекции, возможность осуществления манипуляции в домашних условиях.
Недостатки метода: не происходит полного опорожнения мочевого пузыря, во время манипуляции может потребоваться значительная физическая сила (особенно у крупных собак).
- Уретральная катетеризация. Процедура должна проводиться в максимально стерильных условиях, для каждой катетеризации должен использоваться НОВЫЙ стерильный уретральный катетер. Необходимо выбирать наиболее мягкий катетер (Нелатона, Фолея).
Плюсы метода: полное опорожнение мочевого пузыря.
Недостатки метода: высокий риск развития инфекции мочевыводящей системы, травматизация стенок уретры при каждой катетеризации (риск появления участков сужения по ходу уретры), необходимость транспортировки животного в клинику для проведения манипуляции (при невозможности ее осуществления в домашних условиях).
Если катетер устанавливается на длительный срок, к нему обязательно должна быть присоединена стерильная система для сбора мочи. После извлечения катетера у всех пациентов необходимо брать мочу на бакпосев методом цистоцентеза.
Для стимуляции опорожнения мочевого пузыря могут использоваться следующие группы препаратов:
1.
- ингибиторы холинэстеразы (прозерин, калимин) могут стимулировать сокращение детрузора (хотя их эффективность сомнительна).
- альфа-адреноблокаторы (теразозин) обеспечивают снижение тонуса гладкой мускулатуры в области треугольника мочевого пузыря и проксимального отдела уретры, облегчая отток мочи.
- препараты, снижающие тонус наружного поперечно-полосатого сфинктера уретры (диазепам).
2. Антибиотикотерапия: антибиотики, назначенные после проведения операции, применяются до извлечения уретрального катетера. Если антибактериальная терапия не требуется, то до момента извлечения уретрального катетера применение антибиотиков не рекомендуется (за исключением случаев уже подтвержденной инфекции мочевыводящих путей).
После извлечения уретрального катетера и спустя 5–7 дней после прекращения антибиотикотерапии (если таковая проводилась) берется бакпосев мочи методом цистоцентеза. По его результатам при необходимости назначается курс антибактериальной терапии для купирования инфекции. Если нет возможности осуществить бактериологическое исследование мочи, антибиотиками выбора будут амоксициллин + клавулановая кислота, хлорамфеникол, нитрофурантоин, фторхинолоны. При этом фторхинолоны являются антибиотиками резерва. Продолжительность курса будет зависеть от степени поражения мочевыводящих путей (затронут только мочевой пузырь или совместно с ним поражены почки, тяжесть воспалительного процесса, воспаление локальное или системное). В ситуации, когда поражен только мочевой пузырь и при этом не нарушены его защитные механизмы (сохранена целостность слизистой оболочки, опорожнение мочи происходит в полном объеме и т.д.), продолжительность антибиотикотерапии будет составлять в среднем 14 дней. При поражении почек, нарушении защитных механизмов мочевого пузыря или наличии уросепсиса антибиотики назначаются сроком от 1 месяца. Дальнейшая продолжительность курса зависит от результатов контрольных осмотров и анализов.
3. Увеличение объема образующейся мочи позволит снизить концентрацию в моче бактерий и веществ, раздражающих стенку мочевого пузыря, и увеличить частоту мочеиспусканий для механического вымывания бактерий из мочевыводящих путей. Наиболее оптимальный способ увеличения объема мочи – стимуляция потребления животным большего количества жидкости посредством увеличения количества мисок в доме, применения влажных или размоченных сухих кормов, улучшения вкусовых качеств воды. Существуют промышленные рационы, стимулирующие жажду. В крайнем случае можно прибегать к назначению диуретиков (при отсутствии противопоказаний, например поражения почек).
4. Закисление мочи. Применение закисляющих мочу препаратов оправдано при сдвиге рН мочи в щелочную сторону (7,0 и выше). Закисление мочи в этом случае позволяет повысить ее бактерицидные свойства. Показатель рН мочи должен находиться в диапазоне 6,5–5,5. Если кислотность мочи падает ниже 5,5, закисляющую терапию необходимо прекратить или снизить дозу препарата. Для закисления мочи могут применяться препараты на основе клюквы, метионин, а также специальные закисляющие диеты.
6. Пациенты с постоянной атонией мочевого пузыря
Пациенты с хронической формой нейрогенного мочевого пузыря имеют высокие риски развития инфекции мочевыводящих путей ввиду постоянной задержки мочи и перерастяжения стенок мочевого пузыря.
В связи с этим таким пациентам крайне не рекомендуется устанавливать уретральные катетеры – мочу необходимо отводить мануально не менее двух раз в сутки.
Профилактические осмотры проводятся раз в 1–3 месяца для контроля ультразвуковой картины мочевого пузыря и почек, а также для проведения общего анализа мочи. Бакпосев мочи берется 1 раз в 3–6 месяцев, в зависимости от результатов контрольных осмотров и ОАМ (общего анализа мочи). При наличии инфекции курс антибиотикотерапии у таких пациентов будет продолжаться не менее 1 месяца и зависеть от частоты, степени и метода опорожнения мочевого пузыря (иногда они вынуждены получать антибиотики постоянно).
Источник:https://www.spbvet.info/zhurnaly/3-2018/taktika-vedeniya-patsientov-s-neyrogennym-mochevym-puzyrem/
Развитие обструктивной уропатии вследствие острой задержки мочи у котов. Методы коррекции.
Автор: Андреева Е. А., ветеринарный врач Ветеринарной клиники неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Содержание:
- Этиология и патогенез
- Анамнез и клинические признаки
- Диагностический протокол при поступлении котов с ОЗМ
- Дифференциальная диагностика
- Лечебный протокол при поступлении котов с острой задержкой мочи (ОЗМ)
- Терапия после устранения обструкции
- Терапия после выписки
- Ключевые моменты:
- Прогнозы
Сокращения: ОЗМ – острая задержка мочи, МП – мочевой пузырь, УО – уретральная обструкция, ИМП – инфекция мочевыводящих путей, ОАМ – общий анализ мочи, СКФ – скорость клубочковой фильтрации, ОПП – острое повреждение почек, ИЦК – идиопатический цистит кошек.
Острая задержка мочи – невозможность или недостаточность самостоятельного опорожнения переполненного мочевого пузыря с болезненными позывами на мочеиспускание. Данное патологическое состояние может встречаться у собак и кошек любого пола и возраста, однако практикующие врачи наиболее часто сталкиваются с острой задержкой мочи у котов по причине обструкции уретры. Несмотря на высокую частоту встречаемости данной патологии, некоторые аспекты лечения таких пациентов остаются актуальной темой для обсуждения.
1. Этиология и патогенез
Наиболее распространенными причинами уретральной обструкции у котов являются идиопатический уроцистит и уролитиаз (таблица 1). Воздействие стресс-фактора может вызвать дополнительный спазм мышц уретры у котов по причине наличия большого количества адренергических рецепторов в ее стенке.
Уретральные пробки, являющиеся частой причиной уретральной обструкции у котов, формируются как результат предшествующего идиопатического уроцистита. В результате возникшего воспаления pH мочи возрастает, так как плазма просачивается через поврежденную слизистую оболочку мочевого пузыря, спазм и отек уретры способствуют нарушению оттока мочи. Эти факторы приводят к выпадению в осадок струвитных кристаллов. Воспалительный экссудат (лейкоциты, эритроциты, белок) и слущенный эпителий формируют воспалительный дебрис, который задерживается в отекшей и спазмированной уретре. Позднее в него могут встраиваться струвитные кристаллы, образуя уретральную пробку. Обструкция может возникать без образования уретральных пробок, по причине воспалительного отека и спазма уретры.
В результате нарушения оттока мочи развивается симптомокомплекс, называемый обструктивной уропатией. Термин относится как к местному воздействию, так и к эффектам, возникающим проксимальнее места обструкции (по причине воздействия повышенного гидростатического давления).
Механизм развития обструктивной уропатии:
- Местное воздействие:
- Повреждение уротелия (воспаление, геморрагии, эрозии, некроз, перфорации) → усиление воспалительного отека и спазма.
- Мочевой пузырь:
- Повреждение уротелия → усиление азотемии (абсорбция веществ, растворенных в моче).
- Ишемия стенок → болезненность, геморрагии, некротизация.
- Разрыв соединений гладкомышечных волокон → временная атония детрузора.
- Почки:
- Снижение концентрационной способности → постобструктивный диурез.
- Снижение окисляющей способности → накопление ионов водорода → ацидоз.
- Снижение скорости клубочковой фильтрации → накопление мочевины, креатинина, фосфора, калия.
- Снижение почечного кровотока → длительная ишемия приводит вначале к дегенерации, а затем к острому некрозу почечных канальцев → развитие острого повреждения почек.
Таким образом, при ОЗМ у котов могут развиваться гиперкалиемия, уремия, гиповолемия, метаболический ацидоз и гипокальциемия. При этом гиперкалиемия является наиболее жизнеугрожающим состоянием.
2. Анамнез и клинические признаки
Обычно патология характеризуется внезапным началом и острым течением. В исследовании, включавшем 223 кота, средняя продолжительность от начала клинических признаков (симптомы цистита и частичной обструкции) до полной обструкции составляла 3 дня. [2]
На прием обычно поступают коты с отсутствием мочеиспускания в течение более чем 10–12 часов, мочевыми тенезмами, вокализацией во время и/или между попытками к мочеиспусканию. Признаки уремии развиваются, как правило, к 24–48-му часу обструкции. Они могут включать в себя вялость, анорексию, рвоту, снижение СНК, гипотермию. Может наблюдаться брадикардия как следствие гиперкалиемии (< 100 уд/мин в тяжелых случаях).
3. Диагностический протокол при поступлении котов с ОЗМ:
⦁ Осмотр
При абдоминальной пальпации обычно выявляется переполненный и болезненный мочевой пузырь. При надавливании на мочевой пузырь отделение мочи, как правило, отсутствует. Пенис может быть гиперемирован по причине самотравмирования при вылизывании.
При более длительной задержке мочи могут появляться симптомы поражения почек: снижение СНК, гипотермия [8], уремический запах изо рта, брадикардия.
⦁ УЗИ мочевого пузыря и почек
При УЗИ, как правило, выявляется переполненный мочевой пузырь с изоэхогенной взвесью в его полости. Проксимальная часть уретры может быть расширена. Часто визуализируется выпот в области шейки мочевого пузыря. Иногда удается визуализировать конкремент, вызвавший обструкцию (рис. 2).
Обязательно должно быть проведено УЗИ почек для исключения факта вовлечения их в обструктивный процесс.
⦁ Рентген
Рентген должен обязательно проводиться для исключения рентгеноконтрастных конкрементов в уретре, мочевом пузыре, мочеточниках, почках. При необходимости может быть проведен рентген с контрастом для визуализации уретры (исключение стриктуры и т.д.) (рис. 3).
⦁ Клинический и биохимический анализы крови
После постановки предварительного диагноза ОЗМ необходимо поставить периферический венозный катетер и произвести забор крови на общий клинический, биохимический анализы. Также необходимыми исследованиями являются измерение газов крови и уровня ионизированного кальция.
Частыми находками являются: повышение уровня креатинина и мочевины, гиперкалиемия, гипокальциемия, ацидоз. При этом необходимо помнить, что первичные уровни концентрации мочевины, креатинина и фосфора в сыворотке крови не являются прогностическими признаками выживаемости или продолжительности восстановления функции почек, они лишь прогнозируют тяжесть постобструктивного диуреза.
⦁ Клинический анализ мочи
После установки венозного катетера необходимо провести цистоцентез для отведения основного объема мочи и забора образца мочи на клинический анализ.
Клинический анализ мочи часто выявляет повышение плотности >1,040, pH обычно нейтральный или щелочной (из-за просачивания плазмы крови через поврежденные стенки мочевого пузыря). Эритроциты и белок часто обнаруживаются в моче по причине геморрагий. Количество лейкоцитов и эпителиальных клеток может незначительно увеличиваться, но обычно остается в пределах нормы. Из кристаллов наиболее часто присутствуют струвиты. Бактерий при первичной обструкции, как правило, не обнаруживается (при условии забора мочи на анализ путем цистоцентеза).
⦁ ЭКГ
При необходимости проводится ЭКГ для выявления токсического влияния гиперкалиемии на сердечную мышцу.
4. Дифференциальная диагностика
ОЗМ необходимо дифференцировать от следующих патологий:
⦁ Атония МП
– переполнение МП;
– поражение нижнего двигательного нейрона.
⦁ Напряженный МП
– частичная обструкция (гранулематозный уретрит, стриктуры, заболевания простаты, неоплазия, уролиты);
– функциональная обструкция (детрузорно-сфинктерная диссинергия, поражение верхнего двигательного нейрона, воспаление и болезненность уретры).
⦁ Повышение сократимости детрузора
– воспаление;
– неоплазия стенки.
⦁ Анурия (ОПН, дегидратация, шок).
5. Лечебный протокол при поступлении котов с острой задержкой мочи (ОЗМ)
Сокращения:ОЗМ – острая задержка мочи, МП – мочевой пузырь, УО – уретральная обструкция, ИМП – инфекция мочевыводящих путей, ОАМ – общий анализ мочи, СКФ – скорость клубочковой фильтрации, ОПП – острое повреждение почек, ИЦК – идиопатический цистит кошек.
Цистоцентез
Производится для декомпрессии всех участков мочевыводящей системы и облегчения постановки уретрального катетера. Перед процедурой цистоцентеза рекомендуется провести анальгезию и ввести спазмолитик.
Техника проведения декомпрессионного цистоцентеза:
- Подготовить операционное поле: выбрить шерсть, кожу обработать антисептическим раствором.
- К игле диаметром 22G присоединить систему для внутривенных инфузий и шприц объемом 20–50 мл. Это позволит снизить травматичность манипуляции и предотвратит загрязнение системы микрофлорой (при смене шприцов).
- Иглу следует вводить в область рядом с шейкой мочевого пузыря по направлению к тазовой кости (рис. 5).
- Не рекомендуется полностью опорожнять мочевой пузырь, так как это может вызвать травматизацию слизистой оболочки острым концом иглы.
- Из отведенной мочи следует взять образец для ОАМ (и посева, если требуется).
- При необходимости (невозможность восстановить проходимость уретры, стабилизация тяжелого пациента) цистоцентез можно повторять.
Устранение уретральной обструкции
Анестезиологический протокол
Седация и анальгезия должны проводиться в обязательном порядке всем животным для устранения уретральной обструкции. Применение препаратов для расслабления мышц уретры в то время, когда животное находится в состоянии седации и анальгезии, может увеличить вероятность смещения уретральной пробки и облегчить процедуру постановки уретрального катетера. Животным с тяжелой уремией показана легкая седация или ее отсутствие. Перед проведением седации тяжелые пациенты должны быть стабилизированы.
Стабильный пациент:
- В/м бупренорфин 0,01 мг/кг + ацепромазин 0,05 мг/кг или кетамин 5–10 мг/кг + диазепам 0,25–0,5 мг/кг (диазепам обладает меньшим гипотензивным действием по сравнению с ацепромазином).
- Постановка в/в катетера, декомпрессионный цистоцентез.
- В/в пропофол 2–4 мг/кг.
- Интубация + кислород +/- изофлуран (кислородная маска?).
- Гидропропульсия (Hydropulsion), постановка уретрального катетера.
- Контроль боли каждые 6 часов.
Пациент в критическом состоянии:
- Постановка в/в катетера.
- Бупренорфин 0,005–0,01 мг/кг (по состоянию).
- Декомпрессионный цистоцентез.
- Предварительная стабилизация, в/в инфузия, электролиты.
- В/в пропофол 1–3 мг/кг (по состоянию).
- Эпидуральная анестезия или в/в кетамин 2–5 мг/кг или в/в гидроморфин 0,02–0,05 мг/кг + мидазолам 0,1–0,2 мг/кг (не использовать гидроморфин совместно с бупренорфином).
- Гидропропульсия (Hydropulsion), постановка уретрального катетера.
- Контроль боли каждые 6 часов.

Постановка уретрального катетера
Для устранения обструкции устанавливается уретральный катетер. Процедура должна осуществляться под общей анестезией. Животным в тяжелом состоянии проводится эпидуральная анестезия, либо процедура проводится без седации (см. анестезиологический протокол).
Методика постановки уретрального катетера:
- Поместите животное в дорсальное или латеральное лежачее положение. Иногда одна или другая позиция облегчает экструзию и стабилизацию полового члена (особенно у животных с ожирением).
- Процедуру необходимо проводить как можно более стерильно – это снизит вероятность развития ИМП. Шерсть в перинеальной области выбривают, кожу обрабатывают антисептическим раствором. Рекомендуется ограничить перинеальную область операционным полем.
- Препуций промывают раствором повидон-йода или хлоргексидина. Половой член извлекают из препуция и фиксируют. Удобно захватить пенис влажной марлевой салфеткой. Можно наложить фиксирующие швы на стыке полового члена и препуциального эпителия для лучшего контроля пениса.
- Проведите аккуратный массаж полового члена для попытки спонтанного извлечения уретральной пробки или ее разрыхления. Это может оказаться особенно эффективным, когда пробка находится рядом с наружным отверстием уретры.
- Поскольку наиболее частым местом обструкции является пенисная часть уретры, промывание уретры рекомендуется начинать, используя внутривенный катетер без иглы диаметром 22G. Для промывания можно использовать теплый стерильный физиологический раствор, либо Рингера лактат. Для начала следует попробовать обильно промыть дистальную часть уретры. Это может способствовать расширению уретры и продвижению уретральной пробки дистально между катетером и эпителием уретры и ее выходу через наружное отверстие мочеиспускательного канала.
- При отсутствии положительных результатов применяется гидропропульсия. Промывание смесью 0,9%-го NaCl и водорастворимого лубриканта (50:50) может облегчить прохождение катетера и снизить травматизацию уретры. Повышенная вязкость раствора, связанная с наличием смазочного материала, увеличит давление, создаваемое при промывании, и будет содействовать гидропропульсии. Используется уретральный катетер с открытым концом. Кончик катетера смазывается стерильным вазелином и вводится в наружное отверстие полового члена. Пенис оттягивается каудально, что позволяет максимально выпрямить уретру. Катетер продвигается до места обструкции. Кончик полового члена зажимается влажной марлевой салфеткой и стерильный раствор подается в уретру под давлением. Это способствует расширению мочеиспускательного канала и продвижению обтурирующего предмета проксимально по уретре. Также можно пережать тазовую часть уретры для увеличения гидростатического давления. Для этого в прямую кишку вводят указательный палец в перчатке и прижимают тазовую часть уретры к лонной кости. После нагнетания давления в уретре отпускают ее тазовую часть (но не пенисную), что способствует продвижению конкремента проксимально. Далее катетер продвигают вперед, и манипуляцию повторяют.
- Не пытайтесь силой протолкнуть катетер. Он должен продвигаться свободно, если проведено адекватное промывание уретры. При возникновении затруднений или крепитации при продвижении катетера его необходимо оттянуть каудально и продолжить промывание.
После постановки катетера мочевой пузырь тщательно промывается теплым физиологическим раствором, пока количество дебриса в моче не снизится до минимума. Неполное удаление дебриса из уретры и мочевого пузыря является важной причиной повторной обструкции вскоре после извлечения уретрального катетера.
Не рекомендуется промывать мочевой пузырь растворами антибиотиков, так как это может вызвать появление устойчивых штаммов бактерий. Наилучший способ избежать инфекции – асептическая установка катетера и правильный уход за ним и системой для сбора мочи.
Уретральный катетер оставляется в уретре, если у животного имеется уремия, атония детрузора, в моче наблюдается большое количество дебриса или присутствует видимая кровь. В этом случае рекомендуется заменить жесткий катетер на более мягкий (например, полиуретановый катетер Berotube. Недавние исследования продемонстрировали значительно меньшее количество возникновения рецидивов обструкции при использовании катетеров диаметром 3,5 Fr (1,16 мм) против 5 Fr (1,6 мм). Катетер подшивается к препуцию. К нему присоединяется стерильная система для сбора мочи. Неприемлемо оставлять катетер открытым, так как это значительно увеличивает риск возникновения ИМП. Также не рекомендуется промывать персистирующий уретральный катетер в виду риска заноса инфекции. Мочеприемник должен располагаться ниже уровня мочевого пузыря, чтобы моча стекала под силой тяжести и не возникал обратный ток мочи в мочевой пузырь. Чтобы не создавалось избыточного натяжения на швы, собирательную трубку или длинный конец уретрального катетера можно прикрепить к хвосту или тазовой конечности. Для предотвращения бактериального роста в мочеприемник добавляют 3–5 мл 3%-й перекиси водорода.
Катетер извлекается так скоро, как это возможно, чтобы предотвратить осложнения (например, восходящую инфекцию). Рекомендуется оставлять катетер не более чем на 24–72 часа. Катетер оставляется до очищения мочи, разрешения азотемии и нормализации диуреза.
6. Терапия после устранения обструкции
Инфузионная терапия:
Защелачивающие растворы (например, Рингера лактат, Нормосоль-R) используются в первые 12–24 часа для коррекции ацидоза. По прошествии 12 часов большинство пациентов уже не имеет значимого ацидоза и жидкость может быть заменена на менее защелачивающую (например, 0,9%-й раствор NaCl). [2]
После проведенной регидратации следует восполнять потери, обусловленные постобструктивным диурезом. Основной причиной постобструктивного диуреза является задержка осмотически активных веществ (мочевина, электролиты), а также временная нечувствительность дистальных нефронов к антидиуретическому гормону (АДГ), снижение реабсорбции натрия почечными канальцами, экскреция ранее скопившейся жидкости (особенно после инфузионной терапии). Значительный постобструктивный диурез может приводить к гиповолемии и гипокалиемии. Диурез обычно снижается вместе с разрешением азотемии.
Для коррекции постобструктивного диуреза каждые 4 часа измеряется объем образовавшейся мочи (V). Скорость инфузии на последующие 4 часа будет рассчитываться следующим образом:
Скорость в/в инфузии (мл/ч) = V/4 + 24-часовой поддерживающий объем
(40–60 мл/кг веса)/24.
Разрешение азотемии, как правило, приводит к снижению постобструктивного диуреза. Однако последующий диурез может провоцироваться большими объемами вливаемой жидкости. Для того чтобы определить, восстановился ли диурез, объем инфузии снижают на 25 %. Если диурез уменьшается, то продолжают уменьшение объема инфузии. Если объем образующейся мочи не уменьшается, необходимо вернуться к первоначальной скорости инфузии и повторить снижение через 24–48 часов.
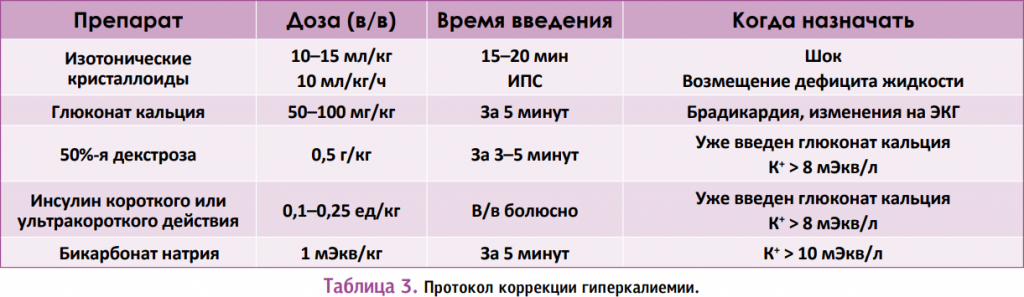
Коррекция гиперкалиемии до 8 мЭкв/л, как правило, включает в/в введение жидкостей (разбавление крови) и не требует дополнительной терапии. Для защиты сердечной мышцы от токсического воздействия калия применяется глюконат кальция (не влияет на концентрацию калия в крови). Для снижения уровня калия (перемещение калия внутрь клетки) используют внутривенное введение декстрозы, инсулина короткого действия. При повышении концентрации калия > 10 мЭкв/л возможно использование бикарбоната натрия.
Для коррекции тяжелого метаболического ацидоза используется бикарбонат натрия в дозе 1 мЭкв/кг, после чего кислотно-щелочной статус проверяется через 15–30 минут.
Коррекция гипокальциемии, как правило, достигается введением раствора глюконата кальция.
При значительном постобструктивном диурезе может происходить вымывание калия, и к 12–24-му часу возможно появление гипокалиемии.
Методы коррекции гипокалиемии:
- Пероральный – наиболее безопасный метод. Поддерживающая доза – 0.5 мЭкв/кг 2–3 раза в сутки до устранения причины (в 1 таблетке «Аспаркам» содержится 1 ммоль калия).
- Внутривенный – метод опасен возможной передозировкой калия. Скорость введения не должна превышать 0,5 мЭкв/кг/ч. Раствор не должен содержать более 60 мЭкв/л калия. [18] Инфузия должна осуществляться под контролем ЭКГ.
Антибактериальная терапия
Не следует назначать антибиотики, пока стоит уретральный катетер (кроме случаев, если ИМП уже подтверждена путем бакпосева мочи). В этом случае антибиотики не предотвращают развитие инфекции, однако могут вызвать появление устойчивых штаммов микроорганизмов. По этой же причине не следует промывать полость мочевого пузыря растворами антибиотиков. Рекомендуется взять мочу на посев после извлечения уретрального катетера.
Спазмолитики и обезболивающие
Спазмолитики и обезболивающие препараты должны применяться в период нахождения катетера в уретре и в течение 5–7 дней после его извлечения (таблица 4).

* Диазепам обладает потенциальной гепатотоксичностью
Г – спазмолитик, воздействующий на гладкую мускулатуру
С – спазмолитик, воздействующий на скелетную (поперечно-полосатую) мускулатуру
Препараты, противопоказанные при УО
Преднизолон:
- не снимает отек, если установлен уретральный катетер
- способствует развитию ИМП
- нет разницы между контрольной и плацебо группами НПВС (мелоксикам):
- нет разницы между контрольной и плацебо группами
- может способствовать развитию ОПП за счет снижения СКФ, особенно у гиповолемичных кошек.
Кетамин не должен использоваться у животных с патологиями сердца, в т.ч. у гиперкалиемичных животных с изменениями на ЭКГ.
Ацепромазин не должен использоваться у животных с гиповолемией.
7. Терапия после выписки
Увеличение объема потребляемой жидкости:
Это основной метод длительного контроля ИЦК. Целью является снижение плотности мочи до 1.030 и меньше. Используются следующие методы:
- Кормление влажными кормами (консервы, паучи).
- Стимуляция поения:
- улучшение вкусовых качеств воды;
- увеличение количества мисок;
- индивидуальный подбор мисок (различные материалы, форма, глубина, объем);
- поилки-фонтанчики;
- Принудительное поение (40–60 мл/кг в сутки).
- П/к введение жидкостей – 40–60 мл/кг в сутки (при необходимости).
Модификация среды обитания:
Включает в себя создание благоприятных условий окружающей среды и уменьшение количества стресс-факторов. Основная цель – снижение активности симпатической нервной системы для предупреждения ИЦК и нейрогенного спазма уретры.
- Места для отдыха, еды и лотка должны быть тихими и защищенными от постороннего воздействия (не на проходе, вдали от собак, детей, шумных приборов). Лоток должен вычищаться ежедневно.
- Количество мисок, лотков – n + 1, где n – количество животных в доме.
- Кошка должна сохранять активность – играть с членами семьи, другими кошками. Игрушки должны быть в достаточном объеме и периодически заменяться.
- В доме должны быть когтеточки.
- Кошка должна иметь возможность свободно передвигаться по дому.
- Корм не должен меняться. При смене корма необходимо дать кошке время, чтобы привыкнуть к смене рациона. При необходимости перехода на новый рацион новый корм постепенно подмешивается к старому с полной заменой рациона в течение 5–7 дней.
- Желателен доступ на улицу.
Анксиолитики:
Препараты, оказывающие успокаивающий эффект, могут быть полезны в восстановительный период:
- Ацепромазин (может применяться только у регидратированных животных);
- Флуоксетин – 1 мг/кг, п/о, 1 раз в сутки, не менее 8 недель.
- Амитриптилин – 2,5–5 мг/кошку (0,5–1 мг/кг) 1 раз в сутки (при тяжелых хронических циститах). Неэффективен при острых циститах – может способствовать рецидивированию, образованию конкрементов, развитию ИМП.
- Feliway – в исследовании 9 котов за 2 месяца были выявлены следующие результаты: пять владельцев (56 %) отметили улучшение общего состояния их животных, в то время как четыре владельца (44 %) не заметили разницы между контрольной и плацебо группами. В долгосрочной перспективе наблюдалось снижение рецидивирования и негативных поведенческих черт.
- Продолжение терапии, направленной на снижение боли и спазмов (в течение 5–7 дней после извлечения уретрального катетера).
- Антибиотикотерапия (по результатам посева).
9. Прогнозы:
В зависимости от причины уретральной обструкции рецидивы происходят примерно в 25–40 % случаев. При возникновении повторной обструкции значительно увеличивается вероятность последующих рецидивов. В этих случаях следует рассматривать вопрос проведения уретростомии.
Источник: https://www.spbvet.info/zhurnaly/2-2017/razvitie-obstruktivnoy-uropatii-nachalo/https://www.spbvet.info/zhurnaly/3-2017/razvitie-obstruktivnoy-uropatii-2/
Оценка результатов биохимического анализа — белки и белковые фракции
Авторы: Ольховский Сергей Юрьевич, заведующий лабораторией, врач лаборант в сети ветеринарных клиник «ООО ВЕГА»; Ольховская Татьяна Владимировна, врач патоморфолог в сети ветеринарных клиник «ООО ВЕГА».
Белки и белковые фракции. Общий белок в сыворотке
В норме концентрация общего белка в сыворотке у собак – 51-72 г/л, у кошек – 58-82 г/л.
У новорожденных концентрация белка ниже нормы (примерно около 40 г/л), но повышается после всасывания иммуноглобулинов, находящихся в молозиве. С возрастом концентрация белка продолжает нарастать.
Гипопротеинемия – пониженный уровень общего белка в крови.
Причины:
1. Гипергидратация (совместно со снижением гематокрита) – относительная
гипопротеинемия;
2. Повышенная потеря белка:
– кровопотери (совместно со снижением гематокрита);
– различные заболевания почек с нефротическим синдромом (за счет потери в основном альбуминов);
– ожоги;
– новообразования;
– сахарный диабет (за счет потери в основном альбуминов);
– асцит (за счет потери в основном альбуминов).
3. Недостаточное введение белка:
– длительное голодание;
– продолжительное соблюдение безбелковой диеты.
4. Нарушение образования белка в организме:
– недостаточная функция печени (гепатиты, циррозы, токсические повреждения);
– длительное лечение кортикостероидами;
– нарушение всасывания (при энтеритах, энтероколитах, панкреатитах).
5. Сочетание различных из перечисленных факторов.
Гиперпротеинемия – повышение концентрации общего белка в крови.
Причины:
1. Дегидратация (в результате потери части внутрисосудистой жидкости):
– тяжелые травмы;
– обширные ожоги;
– неукротимая рвота;
– тяжелая диарея.
2. Острые инфекции (в результате дегидратации и возрастания синтеза белков острой фазы).
3. Хронические инфекции (в результате активации иммунологического процесса и повышенного образования иммуноглобулинов).
4. Появление в крови парапротеинов (образуются при миеломной болезни, хронических гнойных процессах, хронических инфекционных болезнях и т. д.).
5. Физиологическая гиперпротеинемия (активная физическая нагрузка).
Причины ошибочно завышенной концентрации общего белка в плазме крови:
1. Увеличение концентрации небелковых веществ в плазме – липидов, мочевины,
глюкозы, экзогенных агентов (при определении рефрактометром).
2. Липидемия, гипербилирубинемия и значительная гемоглобинемия (при биохимическом
определении).
Альбумин в сыворотке
Концентрация альбумина в сыворотке крови в норме у собак – 24-45 г/л, у кошек – 24-42 г/л. Содержание альбумина в сыворотке крови составляет у собак 45-57%, у кошек – 38- 55% от общего белка.
Альбумины синтезируются печенью (примерно 15 г/сутки), время их полураспада в крови – около 17 суток.
Гипоальбуминемия – низкая концентрация альбуминов в плазме крови.
Гипоальбуминемия ниже 15 г/л ведет к появлению гипопротеинемических отеков и водянок.
а) Первичная идиопатическая – у новорожденных в результате незрелости печеночных клеток.
б) Вторичная – обусловленная различными патологическими состояниями:
1. Гипергидратация;
2. Потери альбумина организмом:
– кровотечение (вместе с уменьшением количества глобулинов);
– нефропатии с потерей белка (развитие нефротического синдрома);
– энтеропатии с потерей белка (вместе с уменьшением количества глобулинов);
– сахарный диабет;
– сильная экссудация при острых воспалениях;
– обширное поражение кожи (ожоги вместе с уменьшением количества глобулинов);
– потеря лимфы при лимфоррагиях, хилотораксе, хилезном асците.
3. Секвестрация альбумина в брюшной (асцит) и/или плевральной (гидроторакс) полостях или подкожной клетчатке:
– повышенное внутрисосудистое давление;
– нарушение циркуляции крови (правосторонняя сердечная недостаточность с повышением давления в печеночной вене);
– повышение давления в печеночной вене различного генеза (шунт, цирроз, новообразования и т. д.) с последующим развитием асцита;
– васкулопатии с повышенной проницаемостью сосудов.
4. Снижение синтеза альбумина из-за первичного поражения печени:
– циррозы печени;
– гепатиты;
– липидоз печени (кошки);
– токсические повреждения печени;
– первичные новообразования и метастазы опухолей, лейкозные поражения печени;
– врожденные портосистемные шунты;
– большая потеря массы печени.
5. Снижение синтеза альбумина без первичного поражения печени:
– гипоальбуминемия индуцированная цитокинами связанными с внепеченочной локализацией воспаления;
– гиперглобулинемия (в т.ч. гипергаммаглобулинемия);
6. Недостаточное поступление:
– длительная диета с низким содержанием белка или безбелковая;
– длительное голодание полное или неполное;
– недостаточность экзокринной функции поджелудочной железы (недостаточность пищеварения);
– недостаточность всасывания (мальабсорбция) при различных болезнях тонкого кишечника (энтеропатии).
7. Снижение функции надпочечников (гипоадренокортицизм собак);
8. Гемодилюция (при беременности);
9. Сочетание вышеперечисленных факторов.Гиперальбуминемия – увеличение содержания альбуминов в сыворотке крови.
Увеличение абсолютного содержания альбуминов, как привило, не наблюдается.
Причины относительной гиперальбуминемии:
1. Дегидратация различного генеза (относительная гиперальбуминемия, развивается одновременно с относительной гиперглобулинемией);
2. Ошибка определения.
Глобулин в сыворотке
Общую концентрацию глобулинов в плазме или сыворотке крови определяют путем вычитания количества альбумина из общего содержания белка.
Глобулины представляют собой гетерогенную группу белка и делятся на фракции (α, β, γ) по подвижности их при электрофорезе.
Таблица 1
Гипоглобулинемия – снижение в сыворотке крови общего содержания глобулинов.
Причины:
1. Гипергидратация (относительная, развивается одновременно с гипопротеинемией и гипоальбуминемией);
2. Выведение глобулинов из организма:
– кровопотеря (развивается одновременно с гипопротеинемией и гипоальбуминемией);
– массивная экссудация (развивается одновременно с гипопротеинемией и гипоальбуминемией);
– энтеропатии с потерей белка (развиваются одновременно с гипопротеинемией и гипоальбуминемией);
3. Нарушение синтеза глобулинов по различным причинам (см. гипопротеинемия);
4. Нарушение переноса иммуноглобулинов из молозива у новорожденных животных.
Ошибочная гипоглобулинемия может быть результатом завышенной концентрации альбуминов (так как количество глобулинов – расчетная величина).
Гиперглобулинемия – повышение в сыворотке крови общего содержания глобулинов.
Причины:
1. Дегидратация различного генеза (вместе с гиперальбуминемией);
2. Усиление синтеза глобулинов:
– воспалительные процессы после тканевых повреждений и/или в ответ на чужеродные антигены;
– неопластические В-лимфоциты и плазматические клетки (множественная миелома, плазмоцитома, лимфома, хронический лимфолейкоз).
Для правильной интерпретации гиперглобулинемии нужно учитывать данные определения общего альбумина и результаты электрофоретического исследования сывороточных белков по фракциям.
Изменение фракции α-глобулинов
К α-глобулинам относится основная масса белков острой фазы.
Увеличение их содержания отражает интенсивность стрессорной реакции и воспалительных процессов.
Причины увеличения фракции α-глобулинов:
1. Острые и подострые воспаления, особенно с выраженным экссудативным и гнойным характером;
– пневмонии;
– пиометра;
– эмпиема плевры и др.
2. Обострение хронических воспалительных процессов;
3. Все процессы тканевого распада или клеточной пролиферации;
4. Поражение печени;
5. Заболевания, связанные с вовлечением в патологический процесс соединительной ткани:
– коллагенозы;
– аутоиммунные болезни.
6. Злокачественные опухоли;
7. Стадия восстановления после термических ожогов;
8. Нефротический синдром;
9. Гемолиз крови в пробирке;
10. Введение фенобарбитала собакам;
11. Повышение концентрации эндогенных глюкокортикоидов (синдром Кушинга) или введение экзогенных глюкокортикоидов.
Причины уменьшения фракции α-глобулинов:
1. Уменьшение синтеза вследствие нехватки ферментов;
2. Сахарный диабет;
3. Панкреатит (иногда);
4. Токсические гепатиты.
Изменение фракции β-глобулинов
Бета-фракция содержит трансферрин, гемопексин, компоненты комплемента, иммуноглобулины (IgM) и липопротеиды.
Причины увеличения фракции β-глобулинов:
1. Первичные и вторичные гиперлипопротеидемии;
2. Нефротический синдром;
3. Заболевания печени;
4. Гипотиреоз;
5. Кровоточащие язвы желудка;
6. Дефицит железа, хронические гемолитические анемии.
Причины уменьшения фракции β-глобулинов:
1. Анемии, связанные с воспалительными заболеваниями (отрицательный острофазный белок).
Изменение фракции γ-глобулинов
Гамма-фракция содержит иммуноглобулины G, D, частично (вместе с бета-фракцией) иммуноглобулины А и Е.
Причины увеличения фракции γ-глобулинов (гипергаммаглобулинемии):
1. Поликлональная гипергаммаглобулинемия или поликлональная гаммапатия (часто совместно с повышением концентрации α2-глобулина, преимущественно при хронических воспалительных или неопластических процессах):
– пиодермия;
– дирофиляриоз;
– эрлихиоз;
– инфекционный перитонит (кошки);
– деструкции (некрозы) тканей, в том числе в крупных неоплазиях;
– ожоги;
– вирусные и/или бактериальные болезни;
– хронические активные гепатиты (к примеру, при хроническом лептоспирозе);
– циррозы печени (если содержание γ-глобулинов превышает содержание α-глобулинов, это плохой прогностический признак);– системная красная волчанка;
– ревматоидный артрит;
– эндотелиомы;
– остеосаркомы;
– кандидамикоз.
2. Моноклональная гипергаммаглобулинемия (моноклональная гаммапатия – появляются патологические протеины – парапротеины):
– клональная пролиферация неопластических клеток типа В-лимфоцитов или плазматических клеток;
– множественная миелома;
– плазмоцитома;
– лимфома;
– хронический лимфолейкоз;
– амилоидоз (редко);
– обширная пролиферация плазматических клеток, не связанная с опухолевым ростом:
– эрлихиоз;
– лейшманиоз;
– плазмоцитарный гастроэнтероколит (собаки);
– лимфоплазмоцитарный стоматит (кошки).
– идиопатическая парапротеинемия.
Причины уменьшения фракции γ-глобулинов (гипогаммаглобулинемия):
1. Первичная гипогаммаглобулинемия:
– физиологическая (у новорожденных животных, примерно до 1 месяца);
– врожденная (наследственный дефект синтеза иммуноглобулинов: комбинированный иммунодефицит бассетов, акродерматит бультерьеров; врожденная селективная недостаточность IgA и IgM у биглей, шарпеев и немецких овчарок);
– идиопатическая.
2. Вторичная гипогаммаглобулинемия (различные болезни и состояния, приводящие к истощению иммунной системы):
– инфекция вирусом лейкоза кошек маленьких котят;
– инфекция вирусом иммунодефицита кошек;
– различные бактериальные болезни, паразитарные (демодекоз) и вирусные болезни (чума плотоядных, парвовирусный энтерит собак, панлейкопения кошек);
– неопластические заболевания, особенно заболевания кроветворной системы;
– хронические болезни почек с уремией;
– сахарный диабет;
– недостаточное или неправильное питание;
– беременность и лактация;
– аутоиммунные болезни.
Интерпретация данных, полученных при одновременном определении концентрации альбумина и общего глобулина.
а) Нормальная концентрация альбумина.
1. Низкая концентрация глобулинов:
– отсутствие пассивного переноса иммуноглобулинов у новорожденных;
– приобретенные или наследственные дефекты синтеза иммуноглобулинов.
2. Нормальная концентрация глобулинов – нормальное состояние.
3. Высокая концентрация глобулинов:
– повышение синтеза глобулинов;
– гипоальбуминемия, маскируемая дегидратацией.
б) Высокая концентрация альбумина.
1. Низкая концентрация глобулинов – ошибка определения, приводящая к ложному завышению концентрации альбумина.
2. Нормальная концентрация глобулинов – маскируемая дегидратацией гипоглобулинемия.
3. Высокая концентрация глобулинов – дегидратация.
в) Низкая концентрация альбумина.
1. Низкая концентрация глобулинов:
– значительная происходящая или недавно случившаяся кровопотеря;
– массивная экссудация;
– энтеропатия с потерей белка.
2. Нормальная концентрация глобулинов:
– нефропатия с потерей белка;
– конечная стадия болезней печени (цирроз);
– нарушения питания;
– гипоадренокортицизм у собак;
– васкулопатии различного генеза (эндотоксемии, септицемия, иммуноопосредованный васкулит, инфекционный гепатит);
– повышенное гидростатическое давление (портальная гипертензия, застойная правосторонняя сердечная недостаточность);
– перитонеальный диализ.
3. Высокая концентрация глобулинов:
– острое, подострое воспаление или хроническое воспаление в стадию обострения;
– множественная миелома, лимфома, плазмоцитома, лимфопролиферативные заболевания.
Гипертиреоз и хроническая болезнь почек у кошек
Автор: Гусева В. А. к.в.н., ветеринарный врач диагностического центра «Прайд», ассистент кафедры акушерства и оперативной хирургии ФГБОУ ВО СПБГАВМ.
Гипертиреоз у кошек – заболевание, сопровождающееся повышенной выработкой тиреоидных гормонов.
Хроническая болезнь почек (ХБП) – это синдром, который является результатом широкого спектра первичных нарушений нефронов со снижением скорости клубочковой фильтрации (СКФ).
Введение
Такие заболевания кошек, как гипертиреоз и ХБП, являются часто встречающимися и, следовательно, могут протекать одновременно. При этом оба этих заболевания успешно маскируют друг друга, что затрудняет их диагностику и лечение. Известно, что между гормонами щитовидной железы и функцией почек существует взаимодействие, при котором протекают физиологически противоречивые процессы.
Ключевой момент затруднений, связанных с диагностикой и лечением, состоит в том, что указанные заболевания по-разному влияют на метаболические процессы, происходящие в организме. При ХБП происходит снижение скорости клубочковой фильтрации и метаболических процессов в целом, в то время как при гипертиреозе наблюдаются повышение уровня метаболических процессов в организме и стимуляция ренин-ангиотензин-альдостероновой системы (РААС), что, в свою очередь, способствует увеличению сердечного выброса и скорости клубочковой фильтрации соответственно6. Согласно данным гуманной медицины, у людей, больных гипертиреозом, СКФ повышается на 18–25% за счет увеличения почечной вазодилатации и уменьшения вазоконстрикции2.
Таким образом, именно различное влияние гипертиреоза и ХБП на скорость клубочковой фильтрации способствует маскировке одного заболевания другим.
Суть патофизиологических процессов
Стимуляция ренин-ангиотензин-альдостероновой системы, вызванная тиреотоксикозом, усиливает реабсорбцию натрия, приводя к увеличению объема циркулирующей плазмы крови, повышению ударного объема, ЧСС и системного артериального давления, что способствует увеличению скорости клубочковой фильтрации. При повышении СКФ маркеры уремии (креатинин и, возможно, мочевина) быстрее метаболизируются и попадают в референтные интервалы. По этой причине при сочетанном протекании ХБП и гипертиреоза мы можем не распознать наличие болезни почек при первичном обследовании пациента.
Возможна и другая ситуация, когда ХБП маскирует гипертиреоз. Данная ситуация связана с тем, что течение различных сопутствующих заболеваний, в том числе и ХБП, может снижать концентрацию общего тироксина в крови. Когда есть выраженная уремия, концентрация общего тироксина может находиться в пределах референтных интервалов, в то время как в действительности происходит избыточная секреция тироксина щитовидной железой. Происходит это потому, что общий тироксин связан с белками плазмы крови и подвержен влиянию не только сопутствующих заболеваний (в том числе и ХБП), но и различных препаратов, что может приводить к ложному снижению его концентрации. Для более точной диагностики необходимо определять концентрацию свободного тироксина в крови, который не связан с белками плазмы (в отличие от общего тироксина) и практически не подвержен колебаниям в зависимости от наличия сопутствующих болезней. Однако достоверное определение концентрации свободного тироксина возможно только с помощью метода равновесного диализа, недоступного в России.
При лечении гипертиреоза у кошек может выявляться нарушение почечной функции, поскольку при достижении эутиреоза (как следствие) будет снижаться стимуляция РААС и СКФ. И при проведении повторных лабораторных исследований концентрация общего тироксина начнет снижаться или будет находиться в пределах референтных интервалов, а маркеры уремии могут начать повышаться в том случае, если тиреотоксикоз скрывает сопутствующее течение ХБП.
Также одной из причин затруднения выявления ХБП при гипертиреозе во время первичного обследования является тот факт, что при гипертиреозе снижается масса тела, в том числе и за счет потери мышечной ткани, вследствие чего происходит уменьшение выработки креатинина у больных гипертиреозом кошек без лечения.
По статистическим данным, примерно у 30% кошек при лечении гипертиреоза развивается уремия7.
Однако усиление СКФ при сочетанном протекании гипертиреоза и ХБП оказывает благотворное влияние на функцию почек лишь на первый взгляд. В действительности же тироксин негативно влияет на все системы организма, приводит к интоксикации, потере мышечной массы, полиурии, а также к гипокалиемии и мышечной слабости при длительном течении заболевания. Также системная артериальная гипертензия, вызванная гипертиреозом, может приводить к гиперфильтрации, дальнейшему ухудшению функционального состояния почек и гломерулосклерозу6.
Клинические признаки
Для гипертиреоза характерны следующие клинические признаки: полиурия, полидипсия, полифагия, рвота, повышенная активность, агрессия, вокализация. Также в 10% случаев может встречаться апатичная форма гипертиреоза, которая проявляется угнетением и анорексией3. Иногда у таких кошек может наблюдаться вентрофлексия головы и шеи, что является следствием гипокалиемии или дефицита тиамина. Клинические признаки могут присутствовать все вместе или по отдельности.
ХБП может сопровождаться полиурией, полидипсией, апатией, рвотой и отказом от корма. При этом полиурия/полидипсия является следствием в большей степени развития ХБП, чем гипертиреоза.
Следовательно, клинические признаки являются схожими с признаками, наблюдаемыми при гипертиреозе у кошек, и для проведения диагностики необходимо соблюдение определенного алгоритма действий и лабораторной диагностики2.
Диагностика
Для проведения диагностики необходимо учитывать наличие клинических признаков и проводить лабораторные исследования концентрации общего тироксина, биохимический и общеклинический анализы крови. Но поскольку получить однозначную картину для постановки диагноза удается не всегда, был разработан определенный алгоритм действий. Когда гипертиреоз протекает самостоятельно, без сопутствующих заболеваний с характерными клиническими признаками и сопровождается повышенной концентрацией общего тироксина в крови, его диагностика не составляет труда.
Однако в тех случаях, когда клиническая картина несколько стерта и имеются сопутствующие патологии (в особенности ХБП), постановка диагноза «гипертиреоз» может оказаться затруднительной. В связи с этим в 2016 году американской ассоциацией практикующих фелинологов были разработаны рекомендации по диагностике и лечению гипертиреоза у кошек. В данном документе к каждой группе больных кошек рекомендован индивидуальный подход:
Кошки с классическими клиническими признаками гипертиреоза и повышенной концентрацией общего тироксина в крови. В данном случае лечение гипертиреоза следует начать незамедлительно. Далее необходимо достичь состояния эутиреоза и оценивать уровни маркеров уремии (креатинина, мочевины) в крови на фоне проводимого лечения, чтобы не пропустить возможное развитие хронической почечной недостаточности (ХПН).
Кошки с классическими клиническими признаками гипертиреоза и нормальной концентрацией общего тироксина. Необходимо иметь в виду, что представители данной группы могут иметь сопутствующее нетиреоидное заболевание, в частности ХПН, и, соответственно, ложное снижение концентрации общего тироксина. В таком случае рекомендованы лечение нетиреоидного заболевания (если оно диагностировано) и повторная пересдача крови на общий тироксин через 2–4 недели. В случае повышенной концентрации общего тироксина необходимо начать лечение гипертиреоза и продолжать мониторинг функции почек.
Кошки с классическими клиническими признаками гипертиреоза и подтвержденным нетиреоидным заболеванием, например ХПН. Вне зависимости от тяжести течения нетиреоидного заболевания лечение гипертиреоза у кошек рекомендуется начинать незамедлительно, поскольку гипертиреоидизм негативно влияет на все системы организма и может приводить к значительному ухудшению состояния животного.
Кошки с субклиническим гипертиреозом. Если у кошек отсутствуют классические клинические признаки и при этом выявлено повышение концентрации общего тироксина в крови, то рекомендовано провести повторное исследование крови на общий тироксин через 1–2 недели. В случае стойкого повышения концентрации общего тироксина в крови (при отсутствии классических клинических признаков) следует начать лечение гипертиреоза с последующим мониторингом концентрации общего тироксина и уровня маркеров уремии в крови.
Поскольку тироксин эпизодически синтезируется у кошек в течение суток, есть вероятность того, что полученный результат исследования концентрации общего тироксина будет находиться в пределах референтных интервалов при наличии гипертиреоза. Поэтому, если присутствуют типичные клинические признаки, рекомендуется обязательно проводить повторное исследование концентрации общего тироксина в крови, например через 2–4 недели. Алгоритм действий приведен в таблице 1.
Таблица 1.
Клиническая картина и лабораторные показатели Кошки с признаками гипертиреоза и повышенной концентрацией Т4 Кошки с признаками гипертиреоза и нормальной концентрацией Т4 Кошки с признаками гипертиреоза и ХБП Кошки с субклиническим гипертиреозом
Диагностический подход Необходимо начать лечение с последующим мониторингом функции почек Следует исключить нетиреоидное заболевание,
в частности ХБП Необходимо начать лечение гипертиреоза и ХБП согласно рекомендациям IRIS Необходимо пересдать кровь для определения концентрации Т4 через 1–2 недели
Необходимо пересдать кровь для определения концентрации Т4 через 2–4 недели При повышенной концентрации Т4 следует начать лечение гипертиреоза с мониторингом Т4 и маркеров уремии в крови
В случае повышенной концентрации Т4 следует начать лечение гипертиреоза и продолжать лечение почек или мониторинг их функции.
Лечение гипертиреоза при наличии ХБП и мониторинг пациентов
Конкретные рекомендации по лечению гипертиреоза зависят от наличия ХБП и ее стадии. По этой причине необходимо оценить функцию почек одновременно с проведением диагностики гипертиреоза. Важно помнить, что дозу метимазола следует подбирать постепенно, чтобы не привести больную кошку в состояние гипотиреоза, что значительно снизит СКФ и ухудшит функцию почек.
На сегодняшний день самым удобным и доступным способом лечения гипертиреоза, особенно когда речь идет о сочетанном течении гипертиреоза и ХБП, остается применение метимазола в таблетированной форме. Этот препарат существует также в виде геля (метимазол гель), но он не всегда доступен на российском рынке, а лечение радиоактивным йодом совсем недоступно.
Специализированная диета не будет являться лечением выбора при сочетании данных патологий и длительном, тяжелом течении гипертиреоза. Однако преимуществом использования диеты является то, что она не будет приводить к развитию каких-либо побочных эффектов4.
При лечении больных гипертиреозом кошек без сопутствующей ХПН на момент первичного обследования назначают метимазол. Дозировка метимазола составляет от 1,25 до 2,5 мг на кошку 2 раза в день. Через 2–3 недели рекомендуется провести повторное исследование крови на концентрацию общего тироксина и маркеры уремии (креатинин, мочевину, фосфор). При достижении эутиреоза рекомендовано оставить выбранную дозу метимазола. В случае сохранения гипертиреоидного состояния на стартовой дозировке метимазола необходимо увеличить дозу на 1,25–2,5 мг 2 раза в день с последующим еженедельным контролем Т4 и маркеров уремии. При достижении эутиреоза оставляют подобранную дозу на том же уровне и проводят повторное мониторирование концентрации общего тироксина и маркеров уремии в крови с периодичностью 1 раз в 3 месяца.
Необходимо иметь в виду, что у неазотемичных кошек при лечении гипертиреоза может развиться азотемия после начала приема метимазола.
Наиболее вероятными кандидатами на развитие азотемии в процессе лечения будут кошки с системной артериальной гипертензией, протеинурией и изостенуричной мочой. Поэтому у неазотемичных кошек так же, как и у азотемичных, необходимо измерять системное артериальное давление, сдавать мочу на общий анализ и проводить оценку уровня протеинурии (соотношение белок/креатинин более 0,4 соответствует протеинурии). Если при достижении эутиреоидного состояния гипертензия и протеинурия сохраняются, они требуют отдельного лечения. Для контроля гипертензии рекомендовано применение атенолола 6,25–12,5 мг 1 раз в день. Для лечения протеинурии необходимо выяснить ее причину. Она может возникнуть из-за инфекции мочевыводящих путей, что требует антибиотикотерапии, либо являться следствием системной артериальной гипертензии. При отсутствии лечения гипертензии и протеинурии время наступления азотемической стадии ХБП сокращается. Микроальбуминурию можно наблюдать при гипертиреозе и ХБП. И, вероятно, такие кошки будут демонстрировать развитие азотемической стадии ХПН в будущем. Также, по некоторым данным, наличие изостенуричной мочи на момент начала лечения гипертиреоза является предиктором развития азотемической стадии ХБП, в том числе и по причине повышенной склонности таких животных к инфекциям мочеполовой системы.
При лечении больных гипертиреозом кошек с азотемической стадией ХПН рекомендован различный подход к лечению в зависимости от стадии заболевания. В любом случае необходимо одновременно начинать лечение и гипертиреоза, и ХБП. Кошек с 1–2-й стадиями ХБП по классификации Международного общества изучения заболеваний почек (англ. International Renal Interest Society; IRIS) рекомендовано лечить от гипертиреоза как пациентов без азотемии. Лечение ХБП необходимо выполнять согласно стадии (1 – креатинин < 140; 2 – креатинин – 140–249) по рекомендациям IRIS. При ХБП 3–4-й стадий (3 – креатинин – 250–439; 4 – креатинин > 440) следует начинать терапию с более низких доз метимазола и подключать активное лечение ХБП также согласно рекомендациям IRIS. При одновременном течении гипертиреоза и ХБП 3–4-й стадий важно помнить о том, что у кошек с умеренной ХБП может быть дефицит эритропоэтина, но анемия может маскироваться гипертиреозом, поскольку для гипертиреоза характерна гемоконцентрация. Развитие же анемии вследствие гипертиреоза является очень редкой ситуацией. Электролитные нарушения, такие как гиперфосфатемия, гипокалиемия и гиперкальциемия, также являются сигналами более поздней стадии ХБП.
Особое внимание необходимо уделить лечению гипертиреоза с помощью тиреоидэктомии. Удаление щитовидной железы показано в случае наличия злокачественного новообразования либо в ситуации, когда пациент благоприятно отвечает на медикаментозное лечение и при этом почечная функция остается стабильной5,8.
Возможные осложнения
К наиболее неблагоприятным последствиям применения метимазола относятся вероятность развития ятрогенного гипотиреоза и, как следствие этого, ухудшение почечной функции. Если в процессе лечения концентрация общего тироксина при последующем мониторинге оказывается ниже референтных интервалов, необходимо незамедлительно снизить дозу метимазола. В случае, если при снижении концентрации общего тироксина маркеры уремии возрастут, некоторые авторы советуют начать лечение L-тироксином. Если у кошки клинически все хорошо и маркеры уремии не ухудшились, следует подождать еще некоторое время, прежде чем принимать решение о приеме L-тироксина.
В случае развития ятрогенного гипотиреоза по причине тиреоидэктомии больным гипертиреозом кошкам без ХБП рекомендован периодический контроль концентрации общего тироксина в крови и уровней маркеров уремии без использования L-тироксина. Применение данного препарата в такой ситуации может быть даже противопоказано, поскольку в этом случае не будут осуществляться стимуляция гипофиза для выработки ТТГ и регенерация тканей щитовидной железы. Однако, если у таких кошек развиваются симптомы гипотиреоза, лечение L-тироксином является необходимым.
У кошек с одновременным протеканием гипертиреоза и ХБП в случае развития ятрогенного гипотиреоза лечение L-тироксином однозначно показано, так как с развитием гипотиреоза при отсутствии его коррекции ХБП будет прогрессировать вследствие снижения СКФ.
Из всего вышесказанного можно сделать вывод о том, что диагностика и лечение гипертиреоза при сопутствующем наличии ХБП являются непростой задачей для клинициста и требуют тщательного анализа всех деталей.
Список литературы:
- Игнатенко Н. А. Клиническая картина, диагностика и лечение гипертиреоза у котов. – VetPharma № 1. – 2013.
- Мельник А. А. Дисфункция щитовидной железы и заболевания почек. Нирки № 1. – 2019, с. 68–72.
- Торранс Э. Д. и Муни К. Т. Эндокринология мелких домашних животных. – «Аквариум». – 2006, 311с.
- Тодд Л. Тауэл. Диетотерапия гипертиреоза у кошек. VetPharma № 5. – 2012, с. 51–54.
- Ссылка 1
- Ссылка 2
- Ссылка 3.
- Ссылка 4